Aturan Markovnikov
Dalam kimia organik, aturan Markovnikov atau aturan Markownikoff menggambarkan hasil beberapa reaksi adisi. Aturan tersebut dirumuskan oleh kimiawan Rusia Vladimir Vasilevich Markovnikov pada tahun 1870.[1][2]
Penjelasan
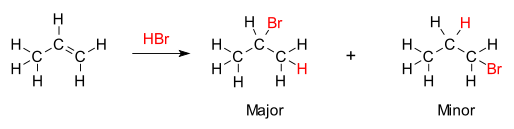
Aturan tersebut menyatakan bahwa penambahan asam protik HX pada alkena asimetris, hidrogen asam (H) akan menempel pada karbon dengan substituen alkil yang lebih sedikit, dan gugus halida (X) akan menempel pada karbon dengan substituen alkil yang lebih banyak. Dengan kata lain, aturan tersebut menyatakan bahwa atom hidrogen ditambahkan ke karbon dengan jumlah atom hidrogen paling banyak sedangkan komponen X ditambahkan ke karbon dengan jumlah atom hidrogen paling sedikit.[3]
Hal yang sama berlaku ketika alkena bereaksi dengan air pada reaksi adisi untuk membentuk alkohol yang melibatkan pembentukan karbokation. Gugus hidroksil (OH) terikat pada karbon yang memiliki jumlah ikatan karbon–karbon lebih banyak, sedangkan hidrogen berikatan dengan karbon di ujung lain dari ikatan rangkap, yaitu yang memiliki ikatan karbon–hidrogen lebih banyak.
Dasar kimia Aturan Markovnikov adalah pembentukan karbokation yang paling stabil selama proses adisi. Adisi ion hidrogen kepada satu atom karbon dalam alkena menciptakan muatan positif pada karbon lainnya, membentuk intermediate karbokation. Semakin tersubstitusi karbokationnya, semakin stabil kondisinya, karena efek induksi dan hiperkonjugasi. Produk utama reaksi adisi adalah yang terbentuk dari intermediate yang lebih stabil. Oleh karena itu, produk utama adisi HX (dengan X adalah beberapa atom yang lebih elektronegatif daripada H) pada alkena memiliki atom hidrogen dalam posisi kurang tersubstitusi dan X pada posisi yang lebih tersubstitusi. Meski demikian, karbokation yang kurang tersubstitusi dan kurang stabil masih akan terbentuk pada konsentrasi tertentu, dan akan menjadi produk minoritas yang berlawanan, ikatan konjugat X.
By
Reaksi anti-Markovnikov
Mekanisme yang tidak melibatkan intermediate karbokation dapat bereaksi melalui mekanisme lain yang memiliki regioselektivitas lainnya yang tidak didikte oleh aturan Markovnikov, seperti adisi radikal bebas. Reaksi semacam itu dikatakan anti-Markovnikov, karena halogen mengadisi karbon yang kurang tersubstitusi, lawan dari reaksi Markovnikov. Mirip dengan spesies bermuatan positif, spesies radikal paling stabil bila elektron yang tidak berpasangan berada pada posisi yang lebih tersubstitusi. Aturan anti-Markovnikov dapat diilustrasikan dengan menggunakan adisi hidrogen bromida pada propena dengan adanya benzoil peroksida. Reaksi HBr dengan alkena tersubstitusi adalah prototipe dalam studi adisi radikal bebas. Ahli kimia awal menemukan bahwa alasan variabilitas rasio produk reaksi Markovnikov terhadap anti-Markovnikov adalah karena kehadiran tak diharapkan zat pengion radikal bebas seperti peroksida. Penjelasannya adalah bahwa HBr menghasilkan radikal Br, yang kemudian bereaksi dengan ikatan rangkap. Oleh karena atom brom relatif besar, maka lebih memungkinkan untuk bertemu dan bereaksi dengan karbon yang paling sedikit tersubstitusi. Dalam kasus propena ini, karbon terminal adalah reaktan yang menghasilkan produk adisi primer, bukan produk adisi sekunder.
Sebuah metode baru adisi anti-Markovnikov telah dijelaskan oleh Hamilton dan Nicewicz, yang memanfaatkan molekul aromatik dan energi cahaya dari dioda berenergi rendah untuk mengubah alkena menjadi radikal kation.[4][5]
Perilaku anti-Markovnikov meluas ke lebih banyak reaksi kimia daripada adisi alkena. Perilaku anti-Markovnikov terlihat pada hidrasi fenilasetilena dengan katalisis aurik, yang menghasilkan asetofenon; meskipun dengan katalis ruthenium khusus[jelas 1] ia menghasilkan regioisomer lainnya, 2-fenilasetaldehida:[6]
Perilaku anti-Markovnikov juga dapat memanifestasikan dirinya dalam reaksi penataan ulang tertentu. Dalam substitusi nukleofilik formal yang dikatalisis oleh titanium(IV) klorida pada enantiopure 1 dalam skema di bawah ini, terbentuk dua produk – 2a dan 2b. Oleh karena terdapat dua pusat khiral dalam molekul target, karbon yang membawa klor dan karbon yang membawa gugus metil dan asetoksietil, maka terbentuk empat senyawa yang berbeda: 1R,2R- (digambarkan sebagai 2b) 1R,2S- 1S,2R- (digambarkan sebagai 2a) dan 1S,2S-. Oleh karena itu, kedua struktur yang digambarkan akan ada dalam bentuk D dan L:[7]
Distribusi produk ini dapat dirasionalkan dengan asumsi bahwa kehilangan gugus hidroksil pada 1 menghasilkan karbokation tersier A, yang menata ulang menjadi karbokation sekunder B yang tampaknya kurang stabil . Klor dapat mendekati pusat ini dari dua arah menghasilkan campuran isomer teramati.
Contoh lain adisi anti-Markovnikov adalah hidroborasi.
Lihat juga
Catatan
Referensi
- ^ W. Markownikoff (1870). "Ueber die Abhängigkeit der verschiedenen Vertretbarkeit des Radicalwasserstoffs in den isomeren Buttersäuren". Annalen der Pharmacie. 153 (1): 228–59. doi:10.1002/jlac.18701530204.
- ^ Hughes, Peter (2006). "Was Markovnikov's Rule an Inspired Guess?". Journal of Chemical Education. 83 (8): 1152. Bibcode:2006JChEd..83.1152H. doi:10.1021/ed083p1152.
- ^ McMurry, John, "6.9", Organic Chemistry (edisi ke-6th), hlm. 187
- ^ Carmen Drahl (April 15, 2013), "Light-Driven Reaction Modifies Double Bonds With Unconventional Selectivity", Chemical & Engineering News, 91 (15), hlm. 8
- ^ Hamilton, David S.; Nicewicz, David A. (October 31, 2012), "Direct Catalytic Anti-Markovnikov Hydroetherification of Alkenols", Journal of the American Chemical Society, 134 (45): 18577–18580, doi:10.1021/ja309635w
- ^ Labonne, Aurélie; Kribber, Thomas; Hintermann, Lukas (2006). "Highly Active in Situ Catalysts for Anti-Markovnikov Hydration of Terminal Alkynes". Organic Letters. 8 (25): 5853–6. doi:10.1021/ol062455k. PMID 17134289.
- ^ Nishizawa, Mugio; Asai, Yumiko; Imagawa, Hiroshi (2006). "TiCl4Induced Anti-Markovnikov Rearrangement". Organic Letters. 8 (25): 5793–6. doi:10.1021/ol062337x. PMID 17134274..