Asam nitrat
Artikel ini perlu diterjemahkan dari bahasa Inggris ke bahasa Indonesia. |
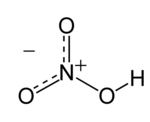
Senyawa kimia asam nitrat (HNO3) adalah sebuah cairan korosif, tak berwarna, dan asam beracun yang dapat menyebabkan luka bakar. Bila suatu larutan asam nitrat terdiri lebih dari 86% asam nitrat, dia disebut sebagai asam nitrat berasap, dan dapat dipisahkan menjadi dua jenis asam, asam nitrat berasap putih dan asam nitrat berasap merah.
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Asam nitrat
| |||
| Nama lain
Hidrogen Nitrat
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Nomor EC | |||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| Sifat | |||
| HNO3 | |||
| Massa molar | 63,012 g/mol | ||
| Penampilan | Cairan bening tidak berwarna | ||
| Densitas | 1,51 g/cm³, cairan tidak berwarna | ||
| Titik lebur | −42 °C (−44 °F; 231 K) | ||
| Titik didih | 83 °C (181 °F; 356 K) | ||
| tercampurkan | |||
| Viskositas | ? cP at ? °C | ||
| 2,17 ± 0,02 D | |||
| Bahaya | |||
Klasifikasi UE (DSD) (usang)
|
Oksidan (O) Korosif (C) | ||
| Frasa-R | R8, R35 | ||
| Frasa-S | (S1/2), S23, S26, S36, S45 | ||
| Titik nyala | tidak tersedia | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Sejarah
Asam nitrat pertama kali disintesis sekitar 800 M oleh ahli alkimia Jabir ibnu Hayyan, yang juga menciptakan distilasi modern dan proses kimiawi dasar lainnya yang masih digunakan sekarang ini.
Sintesis dan produksi
Asam nitrat dibuat dengan mencampur nitrogen dioksida (NO2) dengan air. Menghasilkan asam nitrat yang sangat murni biasanya melibatkan distilasi dengan asam sulfat, karena asam nitrat membentuk sebuah azeotrop dengan air dengan komposisi 68% asam nitrat dan 32% air. Asam nitrat kualitas komersial biasanya memiliki konsentrasi antara 52% dan 68% asam nitrat. Produksi komersial dari asam nitrat melalui proses Ostwald yang ditemukan oleh Wilhelm Ostwald.