Gerak Brown
Gerak Brown adalah gerakan terus menerus dari suatu partikel zat cair ataupun gas, artinya partikel-partikel ini tidak pernah dalam keadaan stasioner atau sepenuhnya diam. Hal ini, pertama kali dibuktikan dan dicetuskan oleh Robert Brown seorang botanis Skotlandia pada tahun 1827. Prinsip gerak ini mudah sekali, Brown mengamati beberapa partikel dengan mikroskop dan dia menemukan bahwa pergerakan terus menerus dari partikel-partikel kecil tersebut makin lama makin cepat bila temperaturnya makin tinggi.
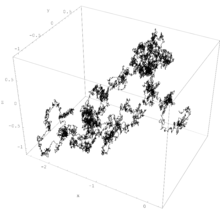
Gerak ini dapat diamati pada zat cair koloid atau gas. Di dalam suatu ruang pergerakan partikel gas tersebut (analogi terhadap zat cair juga) bergerak bebas dan tidak teratur, dengan kata lain partikel gas itu bergerak dengan kecepatan yang berbeda-beda. Bila partikel gas tersebut menabrak partikel gas lain atau menabrak tembok dinding ruang, maka kecepatan serta arah vektornya ikut berubah.
Gerakan Brown ditentukan oleh ukuran molekul dan tenaga kinetiknya. Selama profase gerakan brown bertambah cepat sesuai dengan kenaikan suhu (temperatur). Bersamaan dengan ini kekentalan proplasma menurun.[1]
Penyebaran kecepatan gerakan Brown dapat dirumuskan dengan penyebaran kecepatan Maxwell yang memberikan gambaran bahwa kecepatan partikel tergantung dari temperatur ruang dan lingkungannya.
Kecepatan rata-rata pergerakan molekul di udara adalah 500 m/s atau 1800 km/h. Kecepatan ini melebihi kecepatan gelombang suara yang besarnya 330 m/s. Energi dari partikel gas ideal juga tergantung dari suhu udara.
Teori gas kinetik memberikan hubungan proporsional antara energi rata2 kinetik dengan temperatur gas:
hh
- ^ Issoegianti, S.M. (2016). BMP BIOL4115 Biologi Sel (PDF). Tangerang Selatan: Universitas Terbuka. hlm. 1.3. ISBN 9789790113633.
