Aminoglikosida
Aminoglikosida adalah kategori antibiotik Gram-negatif tradisional yang menghambat sintesis protein dan mengandung glikosida yang dimodifikasi amino (gula) sebagai bagian dari molekulnya.[1][2] Istilah ini juga dapat merujuk secara lebih umum pada molekul organik apa pun yang mengandung substruktur gula amino. Antibiotik aminoglikosida menunjukkan aktivitas bakterisida terhadap bakteri aerob Gram-negatif dan beberapa bakteri kelas bacilli anaerob yang resistensinya belum muncul, tetapi umumnya tidak terhadap bakteri Gram-positif dan bakteri Gram-negatif anaerob.[3]
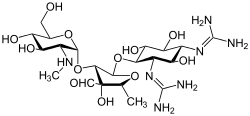
Streptomisin adalah antibiotik aminoglikosida pertama di kelasnya. Obat ini berasal dari Streptomyces griseus dan merupakan agen modern paling awal yang digunakan untuk melawan tuberkulosis. Streptomisin tidak memiliki gugus 2-deoksistreptamin yang umum (gambar kanan, bawah) yang ada di sebagian besar anggota kelas ini. Contoh aminoglikosida lainnya termasuk agen yang mengandung deoksistreptamin kanamisin, tobramisin, gentamisin, dan neomisin (lihat di bawah).

Tata nama
Aminoglikosida yang berasal dari bakteri genus Streptomyces diberi nama dengan sufiks -mycin, sedangkan yang berasal dari Micromonospora[4] diberi nama dengan sufiks -micin.[5] Namun, sistem nomenklatur ini tidak spesifik untuk aminoglikosida, sehingga munculnya rangkaian sufiks ini tidak menyiratkan mekanisme kerja yang sama; misalnya vankomisin (jenis antibiotik glikopeptida),[6] eritromisin[7] (jenis antibiotik makrolida) yang diproduksi oleh Saccharopolyspora erythraea bersama dengan turunan sintetisnya yakni klaritromisin dan azitromisin, semuanya menggunakan sufiks yang sama tetapi memiliki mekanisme kerja yang sangat berbeda.
Anggota
Dalam galeri berikut, kanamisin A hingga netilmisin adalah contoh dari subkelas aminoglikosida deoksistreptamin yang disubstitusi 4,6; neomisin adalah contoh dari subkelas yang disubstitusi 4,5; dan streptomisin adalah contoh dari aminoglikosida non-deoksistreptamin.[2]
-
Neomisin B, C
-
Neomisin E (paromomisin)
Mekanisme kerja
Aminoglikosida menunjukkan aktivitas bakterisida yang bergantung pada konsentrasi terhadap "sebagian besar basil aerobik gram negatif dan anaerobik fakultatif" tetapi tidak terhadap anaerob gram negatif dan sebagian besar bakteri gram positif.[3] Aminoglikosida hanya memerlukan waktu kontak yang singkat, dan paling efektif terhadap populasi bakteri rentan yang berkembang biak dengan cepat.[8] Aktivitas ini dikaitkan dengan cara kerja utama sebagai penghambat sintesis protein, meskipun mekanisme tambahan terlibat untuk beberapa agen tertentu, dan/atau deskripsi mekanistik yang menyeluruh belum tersedia.[2][3][8]
Penghambatan sintesis protein dimediasi melalui pengikatan aminoglikosida yang bergantung pada energi, terkadang ireversibel, ke ribosom bakteri yang terkait dengan membran sitosol (gambar di sebelah kanan).[2] (Aminoglikosida pertama-tama melewati dinding sel bakteri—lipopolisakarida pada bakteri gram negatif—dan membran sel, tempat mereka diangkut secara aktif.[8]) Sementara langkah-langkah spesifik dalam sintesis protein yang terpengaruh mungkin agak bervariasi antara agen aminoglikosida tertentu, seperti halnya afinitas dan tingkat pengikatannya,[8] keberadaan aminoglikosida dalam sitosol umumnya mengganggu pemanjangan peptida pada subunit ribosom 30S, sehingga menimbulkan translasi mRNA yang tidak akurat dan karenanya biosintesis protein yang terpotong, atau memiliki komposisi asam amino yang berubah pada titik-titik tertentu.[2] Secara khusus, pengikatan merusak pemeriksaan translasi yang menyebabkan kesalahan pembacaan pesan RNA, penghentian prematur, atau keduanya, dan dengan demikian menyebabkan ketidakakuratan produk protein yang diterjemahkan. Subset protein abnormal yang dimasukkan ke dalam membran sel bakteri kemudian dapat menyebabkan perubahan permeabilitasnya dan kemudian "stimulasi lebih lanjut dari transpor aminoglikosida".[2] Bagian gula amino dari golongan molekul ini (misalnya, 2-deoksistreptamin dalam kanamisin, gentamisin, dan tobramisin, lihat di atas) terlibat dalam asosiasi molekul kecil dengan struktur ribosom yang menyebabkan ketidaksesuaian dalam penerjemahan (ibid.). Penghambatan translokasi ribosom—yaitu, pergerakan peptidil-tRNA dari situs A ke situs P—juga telah disarankan[rujukan diperlukan]. Eksperimen pelacakan molekul tunggal baru-baru ini pada E. coli hidup menunjukkan sintesis protein yang terus berlangsung tetapi lebih lambat setelah pengobatan dengan obat aminoglikosida yang berbeda.[9] (Spektinomisin, golongan struktur kimia terkait tetapi berbeda yang sering dibahas dengan aminoglikosida, tidak menyebabkan kesalahan pembacaan mRNA dan umumnya tidak bersifat bakterisida.)[8]
Telah diusulkan bahwa antibiotik aminoglikosida menyebabkan oksidasi nukleotida guanin dalam kumpulan nukleotida bakteri, dan hal ini berkontribusi terhadap sitotoksisitas antibiotik ini.[10] Penggabungan nukleotida guanin teroksidasi ke dalam DNA dapat bersifat bakterisida karena perbaikan yang tidak tuntas dari 8-oxo-2'-deoxyguanosine yang berjarak dekat dalam DNA dapat mengakibatkan kerusakan untai ganda yang mematikan.[10]
Terakhir, "efek membran sel" lebih lanjut juga terjadi dengan aminoglikosida; "integritas fungsional membran sel bakteri" dapat hilang, di kemudian hari dalam perjalanan waktu paparan dan pengangkutan aminoglikosida.[11]
Farmakokinetika dan farmadinamika
Terdapat variabilitas yang signifikan dalam hubungan antara dosis yang diberikan dan kadar plasma yang dihasilkan dalam darah.[rujukan?] Pemantauan obat terapeutik (TDM) diperlukan untuk mendapatkan dosis yang tepat. Agen-agen ini menunjukkan efek pasca-antibiotik di mana tidak ada atau sangat sedikit kadar obat yang terdeteksi dalam darah, tetapi tampaknya masih ada penghambatan pertumbuhan kembali bakteri. Hal ini disebabkan oleh ikatan yang kuat dan ireversibel dengan ribosom, dan tetap berada di dalam sel lama setelah kadar plasma turun, dan memungkinkan interval dosis yang diperpanjang.[rujukan?] Bergantung pada konsentrasinya, mereka bertindak sebagai agen bakteriostatik atau bakterisida.[12]
Indikasi
Aminoglikosida bermanfaat terutama untuk infeksi yang melibatkan bakteri aerobik Gram-negatif, seperti Pseudomonas, Acinetobacter, dan Enterobacter. Selain itu, beberapa Mycobacteria, termasuk bakteri penyebab tuberkulosis, rentan terhadap aminoglikosida. Streptomisin adalah obat pertama yang efektif dalam pengobatan tuberkulosis, meskipun peran aminoglikosida seperti streptomisin dan amikasin telah diabaikan (karena toksisitasnya dan rute pemberiannya yang tidak nyaman) kecuali untuk strain yang resistan terhadap banyak obat.[diperlukan kutipan] Penggunaan aminoglikosida yang paling sering adalah terapi empiris untuk infeksi serius seperti sepsis, infeksi intra-abdomen yang rumit, infeksi saluran kemih yang rumit, dan infeksi saluran pernapasan nosokomial. Biasanya, setelah kultur organisme penyebab tumbuh dan kerentanannya diuji, aminoglikosida dihentikan dan diganti dengan antibiotik yang kurang toksik.[diperlukan kutipan]
Seperti yang telah disebutkan, aminoglikosida sebagian besar tidak efektif terhadap bakteri anaerob, jamur, dan virus.[2] Infeksi yang disebabkan oleh bakteri Gram-positif juga dapat diobati dengan aminoglikosida, tetapi jenis antibiotik lain lebih manjur dan tidak terlalu merusak bagi inang. Di masa lalu, aminoglikosida telah digunakan bersama dengan antibiotik beta-laktam pada infeksi streptokokus karena efek sinergisnya, khususnya pada endokarditis. Salah satu kombinasi yang paling sering digunakan adalah ampisilin (beta-laktam, atau antibiotik yang berhubungan dengan penisilin) dan gentamisin. Sering kali, staf rumah sakit menyebut kombinasi ini sebagai "amp and gent" atau yang lebih baru disebut "pen and gent" untuk penisilin dan gentamisin.[rujukan diperlukan]
Penekanan yang tidak masuk akal
Interferensi dengan proofreading mRNA telah dieksploitasi untuk mengobati penyakit genetik yang diakibatkan oleh kodon stop prematur (yang menyebabkan penghentian dini sintesis protein dan protein terpotong). Aminoglikosida dapat menyebabkan sel mengatasi kodon stop, memasukkan asam amino acak, dan mengekspresikan protein dengan panjang penuh.[13] Aminoglikosida gentamisin telah digunakan untuk mengobati sel fibrosis kistik (CF) di laboratorium untuk mendorong sel tersebut menumbuhkan protein dengan panjang penuh. CF disebabkan oleh mutasi pada gen yang mengkode protein pengatur konduktansi transmembran (CFTR) fibrosis kistik. Pada sekitar 10% kasus CF, mutasi pada gen ini menyebabkan penghentian dini selama translasi, yang menyebabkan pembentukan protein CFTR yang terpotong dan tidak berfungsi. Dipercaya bahwa gentamisin mendistorsi struktur kompleks ribosom-RNA, yang menyebabkan kesalahan pembacaan kodon terminasi, menyebabkan ribosom "melewati" urutan penghentian dan melanjutkan pemanjangan dan produksi protein CFTR yang normal.[14]
Rute pemberian
Karena tidak diserap dari usus, obat ini diberikan secara intravena dan intramuskular. Beberapa obat digunakan dalam sediaan topikal untuk luka. Pemberian secara oral dapat digunakan untuk dekontaminasi usus (misalnya, pada ensefalopati hepatik). Tobramisin dapat diberikan dalam bentuk nebulisasi.[8]
Kegunaan klinis
Munculnya infeksi baru-baru ini akibat strain bakteri Gram-negatif dengan pola resistansi antimikroba yang lebih maju telah mendorong dokter untuk mengevaluasi kembali penggunaan agen antibakteri ini.[9] Minat yang kembali muncul dalam penggunaan aminoglikosida ini telah menyoroti kembali perdebatan tentang dua isu utama yang terkait dengan senyawa ini, yaitu spektrum kerentanan dan toksisitas antimikroba. Bukti terkini menunjukkan bahwa aminoglikosida tetap aktif terhadap sebagian besar isolat bakteri klinis Gram-negatif di banyak bagian dunia. Namun, kejadian nefrotoksisitas dan ototoksisitas yang relatif sering selama pengobatan aminoglikosida membuat dokter enggan menggunakan senyawa ini dalam praktik sehari-hari. Kemajuan terkini dalam pemahaman tentang efek berbagai jadwal dosis aminoglikosida terhadap toksisitas telah memberikan solusi parsial untuk masalah ini, meskipun penelitian lebih lanjut masih perlu dilakukan untuk mengatasi masalah ini sepenuhnya.[10]
Aminoglikosida termasuk dalam kategori kehamilan D,[11] yaitu, terdapat bukti positif risiko janin manusia berdasarkan data reaksi merugikan dari pengalaman investigasi atau pemasaran atau studi pada manusia, namun potensi manfaatnya mungkin memerlukan penggunaan obat pada wanita hamil meskipun terdapat potensi risiko.
Efek samping
Aminoglikosida dapat menyebabkan toksisitas telinga bagian dalam yang dapat mengakibatkan gangguan pendengaran sensorineural.[12] Insiden toksisitas telinga bagian dalam bervariasi dari 7 hingga 90%, tergantung pada jenis antibiotik yang digunakan, kerentanan pasien terhadap antibiotik tersebut, dan durasi pemberian antibiotik.[13]
Efek samping lain yang serius dan melumpuhkan dari penggunaan aminoglikosida adalah ototoksisitas vestibular.[12] Hal ini menyebabkan oscillopsia (ketidakstabilan pandangan) dan gangguan keseimbangan yang memengaruhi semua aspek fungsi antigravitasi seseorang. Kehilangan ini bersifat permanen dan dapat terjadi pada dosis berapa pun.[14][15][16][17]
Penggunaan aminoglikosida yang sering dapat mengakibatkan kerusakan ginjal (cedera ginjal akut), yang dapat menyebabkan gagal ginjal kronis.[18]
Kontraindikasi untuk penyakit tertentu
Aminoglikosida dapat memperburuk kelemahan pada pasien dengan miastenia gravis, dan oleh karena itu penggunaan obat ini dihindari pada pasien tersebut.[19]
Aminoglikosida dikontraindikasikan pada pasien dengan penyakit mitokondria karena dapat mengakibatkan gangguan penerjemahan mtDNA, yang dapat menyebabkan kehilangan pendengaran yang ireversibel, tinitus, toksisitas jantung, dan toksisitas ginjal. Namun, kehilangan pendengaran dan tinitus juga telah diamati pada beberapa pasien tanpa penyakit mitokondria.[20]
Referensi
- ^ E.g., see www.merriam-webster.com/medical/aminoglycoside: "any of a group of antibiotics (as streptomycin and neomycin) that inhibit bacterial protein synthesis and are active especially against gram-negative bacteria".
- ^ a b Mingeot-Leclercq MP, Glupczynski Y, Tulkens PM (1999). "Aminoglycosides: activity and resistance". Antimicrob. Agents Chemother. 43 (4): 727–37. doi:10.1128/AAC.43.4.727. PMC 89199 . PMID 10103173.
- ^ ME Levison, MD, 2012, Aminoglycosides, The Merck Manual [1], accessed 22 February 2014.
- ^ Kroppenstedt RM, Mayilraj S, Wink JM (June 2005). "Eight new species of the genus Micromonospora, Micromonospora citrea sp. nov., Micromonospora echinaurantiaca sp. nov., Micromonospora echinofusca sp. nov. Micromonospora fulviviridis sp. nov., Micromonospora inyonensis sp. nov., Micromonospora peucetia sp. nov., Micromonospora sagamiensis sp. nov., and Micromonospora viridifaciens sp. nov". Syst Appl Microbiol. 28 (4): 328–39. Bibcode:2005SyApM..28..328K. doi:10.1016/j.syapm.2004.12.011. PMID 15997706.
- ^ Paul M. Dewick (2009). Medicinal Natural Products: A Biosynthetic Approach (edisi ke-3rd). Wiley. ISBN 978-0-470-74167-2.
- ^ Hammes, Walter P.; Neuhaus, Francis C. (1974). "On the Mechanism of Action of Vancomycin: Inhibition of Peptidoglycan Synthesis in Gaffkya homari". Antimicrobial Agents and Chemotherapy. 6 (6): 722–8. doi:10.1128/AAC.6.6.722. PMC 444726 . PMID 4451345.
- ^ Tenson T, Lovmar M, Ehrenberg M (July 2003). "The mechanism of action of macrolides, lincosamides and streptogramin B reveals the nascent peptide exit path in the ribosome". J Mol Biol. 330 (5): 1005–14. doi:10.1016/s0022-2836(03)00662-4. PMID 12860123.
- ^ Pai VB, Nahata MC (October 2001). "Efficacy and safety of aerosolized tobramycin in cystic fibrosis". Pediatr. Pulmonol. 32 (4): 314–27. doi:10.1002/ppul.1125. PMID 11568993.
- ^ Falagas, Matthew E; Grammatikos, Alexandros P; Michalopoulos, Argyris (2008). "Potential of old-generation antibiotics to address current need for new antibiotics". Expert Review of Anti-infective Therapy. 6 (5): 593–600. doi:10.1586/14787210.6.5.593. PMID 18847400.
- ^ Durante-Mangoni, Emanuele; Grammatikos, Alexandros; Utili, Riccardo; Falagas, Matthew E. (2009). "Do we still need the aminoglycosides?". International Journal of Antimicrobial Agents. 33 (3): 201–5. doi:10.1016/j.ijantimicag.2008.09.001. PMID 18976888.
- ^ Merck Manual: Bacteria and Antibacterial Drugs: Aminoglycosides Last full review/revision July 2009 by Matthew E. Levison, MD
- ^ a b Selimoglu, Erol (2007). "Aminoglycoside-induced ototoxicity". Current Pharmaceutical Design. 13 (1): 119–126. doi:10.2174/138161207779313731. PMID 17266591.
- ^ L, Peterson; C, Rogers (18 February 2015). "Aminoglycoside-induced hearing deficits – a review of cochlear ototoxicity". South African Family Practice. 57 (2): 77–82. doi:10.1080/20786190.2014.1002220 .
- ^ Black, FO; Pesznecker, S; Stallings, V (July 2004). "Permanent gentamicin vestibuloxicity". Otology and Neurotology. 25 (4): 559–69. doi:10.1097/00129492-200407000-00025. PMID 15241236.
- ^ Ahmed, RM; Hannigan, IP; MacDougall, HG; Chan, RC; Halmagyi, GM (18 June 2012). "Gentamicin ototoxicity: a 23-year selected case series of 103 patients". Medical Journal of Australia. 196 (11): 701–4. doi:10.5694/mja11.10850 . PMID 22554194.
- ^ Ahmed, RM; MacDougall, HG; Halmagyi, GM (September 2011). "Unilateral vestibular loss due to systemically administered gentamicin". Otology and Neurotology. 32 (7): 1158–62. doi:10.1097/MAO.0b013e31822a2107. PMID 21844784.
- ^ Ishiyama, G; Ishimaya, A; Kerber, K; Baloh, RW (October 2006). "Gentamicin ototoxicity: clinical features and the effect on the human vestibulo-ocular reflex". Acta Otolaryngologica. 126 (10): 1057–61. doi:10.1080/00016480600606673. PMID 16923710.
- ^ Prayle A, Watson A, Fortnum H, Smyth A (July 2010). "Side effects of aminoglycosides on the kidney, ear and balance in cystic fibrosis". Thorax. 65 (7): 654–8. doi:10.1136/thx.2009.131532. PMC 2921289 . PMID 20627927.
- ^ Mehta, Gautam; Iqbal, Bilal (2010). Clinical Medicine for the MRCP PACES: Volume 1: Core Clinical Skills. Oxford University Press. doi:10.1093/oso/9780199542550.001.0001. ISBN 9780199542550. OCLC 1222774465.
- ^ referenced in Bindu, LH; Reddy, PP (2008). "Genetics of aminoglycoside-induced and prelingual non-syndromic mitochondrial hearing impairment: a review". Int J Audiol. 47 (11): 702–7. doi:10.1080/14992020802215862. PMID 19031229. See Also Fischel-Ghodsian, N (1999). "Genetic factors in aminoglycoside toxicity". Ann N Y Acad Sci. 884 (1): 99–109. Bibcode:1999NYASA.884...99F. doi:10.1111/j.1749-6632.1999.tb08639.x. PMID 10842587.
Pranala luar
- MedlinePlus drug information - Aminoglycosides (Systemic)
- Science Daily Bacterial 'Battle for Survival' - Rhodostreptomycin
- Wikiversity page for the International Ototoxicity Management Group