Enfuvirtid
Enfuvirtid (INN) adalah penghambat fusi HIV, yang pertama dari kelas obat antiretroviral yang digunakan dalam terapi kombinasi untuk pengobatan HIV/AIDS.
| |
|---|---|
| Data klinis | |
| Nama dagang | Fuzeon |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a603023 |
| Data lisensi | US Daily Med:pranala |
| Kat. kehamilan | B2(AU) |
| Status hukum | Harus dengan resep dokter (S4) (AU) ℞-only (CA) POM (UK) ℞-only (US) |
| Rute | subkutan |
| Data farmakokinetik | |
| Bioavailabilitas | 84,3% (subkutan) |
| Ikatan protein | 92% |
| Metabolisme | Hati |
| Waktu paruh | 3,8 jam |
| Ekskresi | tidak diketahui |
| Pengenal | |
| Nomor CAS | 159519-65-0 |
| Kode ATC | J05AX07 |
| PubChem | CID 16130199 |
| DrugBank | DB00109 |
| ChemSpider | 16743716 |
| UNII | 19OWO1T3ZE |
| KEGG | D02499 |
| ChEBI | CHEBI:608828 |
| ChEMBL | CHEMBL525076 |
| NIAID ChemDB | AIDSNO:059486 |
| Data kimia | |
| Rumus | C204H301N51O64 |
| SMILES | eMolecules & PubChem |
| |
Sejarah
suntingEnfuvirtid berasal dari Universitas Duke, tempat para peneliti membentuk perusahaan farmasi yang dikenal sebagai Trimeris. Trimeris mulai mengembangkan enfuvirtid pada tahun 1996 dan awalnya menyebutnya T-20. Pada tahun 1999, Trimeris menjalin kemitraan dengan Hoffmann-La Roche untuk menyelesaikan pengembangan obat tersebut. Obat ini disetujui oleh Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) pada tanggal 13 Maret 2003[1]
Kegunaan dalam medis
suntingEnfuvirtide diindikasikan untuk pengobatan infeksi HIV-1, dalam terapi kombinasi dengan antiretroviral lain, pada orang yang semua pengobatan lain telah gagal.[2]
Efek samping
suntingReaksi obat yang tidak diinginkan yang umum (≥1% pasien) yang terkait dengan terapi enfuvirtid meliputi: reaksi pada tempat suntikan (nyeri, pengerasan kulit, eritema infektiosum, nodul, kista, gatal; dialami oleh hampir semua pasien, terutama pada minggu pertama), neuropati perifer, insomnia, gangguan depresi mayor, batuk, dispnea, anoreksia, artralgia, infeksi (termasuk pneumonia bakteri) dan/atau eosinofilia. Berbagai reaksi hipersensitivitas jarang terjadi (0,1–1% pasien), gejalanya meliputi ruam, demam, mual, muntah, menggigil, hipotensi, peningkatan transaminase hati; dan kemungkinan reaksi yang lebih parah termasuk gangguan pernapasan, glomerulonefritis dan/atau anafilaksis. Pemberian ulang tidak direkomendasikan.[2]
Farmakologi
suntingMekanisme kerja
suntingHIV mengikat reseptor sel CD4+ inang melalui protein virus gp120; gp41, protein transmembran virus, kemudian mengalami perubahan konformasi yang membantu fusi membran virus ke membran sel inang. Enfuvirtid mengikat gp41 untuk mencegah terbentuknya pori masuk bagi kapsid virus, sehingga virus tidak dapat masuk ke dalam sel.[3]
Enfuvirtid juga merupakan aktivator reseptor faktor kemotaktik, reseptor peptida formil 1, dan dengan demikian mengaktifkan fagosit dan mungkin sel lain yang mengandung reseptor ini.[4]
Mikrobiologi
suntingEnfuvirtid dianggap aktif terhadap HIV-1 saja. Aktivitas rendah terhadap isolat HIV-2 telah dibuktikan secara in vitro.[5]
Kerentanan yang bervariasi terhadap enfuvirtid telah diamati pada isolat klinis, dengan resistensi yang didapat sebagai hasil dari motif 10 asam amino yang bermutasi pada gp41 virus. Namun, resistensi primer belum diamati.[6]
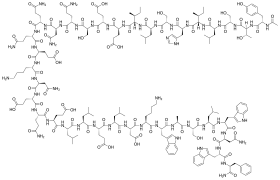
Rumus struktur
suntingEnfuvirtid adalah peptida dengan 36 asam amino dengan urutan sebagai berikut:[7][8]
CH3CO-Tyr-Thr-Ser-Leu-Ile-His-Ser-Leu-Ile-Glu-Glu-Ser-Gln-Asn-Gln-Gln-Glu-Lys-Asn-Glu-Gln-Glu-Leu-Leu-Glu-Leu-Asp-Lys-Trp-Ala-Ser-Leu-Trp-Asn-Trp-Phe-NH2 (Ac-YTSLIHSLIEESQNQQEKNEQELLELDKWASLWNWF-2)
Referensi
sunting- ^ "Drugs@FDA: FDA Approved Drug Products – Fuzeon (Click on 'Approval Date(s) and History, Letters, Labels, Reviews for NDA 021481')". accessdata.fda.gov. United States Food and Drug Administration. Diarsipkan dari versi asli tanggal 28 June 2017. Diakses tanggal 6 January 2019.
- ^ a b Rossi S, ed. (2006). Australian Medicines Handbook. Adelaide: Australian Medicines Handbook Pty Ltd. ISBN 0-9757919-2-3.
- ^ Lalezari JP, Eron JJ, Carlson M, Cohen C, DeJesus E, Arduino RC, et al. (March 2003). "A phase II clinical study of the long-term safety and antiviral activity of enfuvirtide-based antiretroviral therapy". AIDS. 17 (5): 691–8. doi:10.1097/00002030-200303280-00007 . PMID 12646792.
- ^ Su SB, Gong WH, Gao JL, Shen WP, Grimm MC, Deng X, et al. (June 1999). "T20/DP178, an ectodomain peptide of human immunodeficiency virus type 1 gp41, is an activator of human phagocyte N-formyl peptide receptor". Blood. 93 (11): 3885–92. doi:10.1182/blood.V93.11.3885. PMID 10339497.
- ^ Roche Products Pty Ltd. Fuzeon (Australian Approved Product Information). Dee Why (NSW): Roche; 2005.
- ^ Greenberg ML, Cammack N (August 2004). "Resistance to enfuvirtide, the first HIV fusion inhibitor". The Journal of Antimicrobial Chemotherapy. 54 (2): 333–40. doi:10.1093/jac/dkh330 . PMID 15231762.
- ^ Wild C, Greenwell T, Shugars D, Rimsky-Clarke L, Matthews T (1995). "The Inhibitory Activity of an HIV Type 1 Peptide Correlates with Its Ability to Interact with a Leucine Zipper Structure". AIDS Research and Human Retroviruses. 11 (3): 323–25. doi:10.1089/aid.1995.11.323. PMID 7786578.
- ^ De Clercq E (July 1995). "Toward Improved Anti-HIV Chemotherapy: Therapeutic Strategies for Intervention with HIV Infections". Journal of Medicinal Chemistry. 38 (14): 2491–2517. doi:10.1021/jm00014a001. PMID 7543152.