Antibiotik beta-laktam
Antibiotik beta-laktam adalah golongan antibiotika yang memiliki kesamaan komponen struktur berupa adanya cincin beta-laktam dan umumnya digunakan untuk mengatasi infeksi bakteri[1]. Terdapat sekitar ± 56 macam antibotik beta-laktam yang memiliki antivitas antimikrobial pada bagian cincing beta-laktamnya dan apabila cincin tersebut dipotong oleh mikoorganisme makan akan terjadi resistensi terhadap antibiotik tersebut[2].
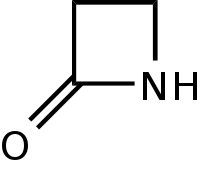
Mekanisme kerja
Antibiotik beta-laktamase bekerja membunuh bakteri dengan cara menginhibisi sintesis dinding selnya[3]. Pada proses pembentukan dinding sel, terjadi reaksi transpeptidasi yang dikatalis oleh enzim transpeptidase dancmenghasilkan ikatan silang antara dua rantai peptida-glukan[3]. Enzim transpeptidase yang terletak pada membran sitoplasma bakteri tersebut juga dapat mengikat antibiotik beta-laktam sehingga menyebabkan enzim ini tidak mampu mengkatalisis reaksi transpeptidasi walaupun dinding sel tetap terus dibentuk<ref="c"></ref>. Dinding sel yang terbentuk tidak memiliki ikatan silang dan peptidoglikan yang terbentuk tidak sempurna sehingga lebih lemah dan mudah terdegradasi[3]. Pada kondisi normal, perbedaan tekanan osmotik di dalam sel bakteri gram negatif dan di lingkungan akan membuat terjadinya lisis sel[3]. Selain itu, kompleks protein transpeptidase dan antibiotik beta-laktam akan menstimulasi senyawa autolisin yang dapat mendigesti dinding sel bakteri tersebut[3]. Dengan demikian, bakteri yang kehilangan dinding sel maupun mengalami lisis akan mati[3].
Mekanisme resistensi
Beberapa bakteri diketahui memiliki resitensi terhadap antibiotik beta-laktam, salah satu diantaranya adalah golongan Streptococcus aureus resisten-metisilin (Methicillin resistant Staphylococcus aureus/MRSA)[4]. Bakteri-bakteri yang resisten terhadap antibiotik beta-laktam memiliki 3 mekanisme reistensi, yaitu destruksi antibiotik dengan beta-laktamase, menurunkan penetrasi antibiotik untuk berikatan dengan protein transpepidase, dan menurunkan afinitas ikatan antara protein pengikat tersebut dengan senyawa antibiotik[5]. Beberapa bakteri seperti Haemophilus influenzae, golongan Staphylococcus, dan sebagian besar bakteri enterik berbentuk batang memiliki enzim beta-laktamase yang dapat memecah cincin beta-laktam pada antibiotik tersebut dan membuatnya menjadi tidak aktif[5]. Secara detail, mekanisme yang terjadi diawali dengan pemutusan ikatan C-N pada cincin beta-laktam dan mengakibatkan antibiotik tidak dapat berikatan dengan protein transpeptdase sehingga terjadi kehilangan kemampuan untuk menginhibisi pembentukan dinding sel bakteri[6]. Beberapa studi menyatakan bahwa selain ditemukan secara alami pada bakteri gram positif dan negatif, gen penyandi enzim beta-laktamase juga ditemukan pada plasmida dan transposon sehingga dapat ditransfer antarspesies bakteri[7]. Hal ini menyebabkan kemampuan resistensi akan antibiotik beta-laktam dapat menyebar dengan cepat[7]. Difusi antibiotik beta laktam ke dalam sel bakteri terjadi melalui perantaraan protein transmembran yang disebut porine dan kemampuan difusinya dipengaruhi oleh ukuran, muatan, dan sifat hidrofilik dari suatu antibiotik[6].
Mengatasi resistensi antibiotik beta-laktam
Untuk mengatasi degradasi cincing beta-laktam, beberapa antibiotik beta-laktam dikombinasikan dengan senyawa inhibitor enzim beta-laktamase seperti asam clavulanat, tazobactam, atau sulbactam[2]. Salah satu antibiotik beta-laktam yang resisten beta laktamase adalah augmentin, kombinasi amoxycillin dan asam klavulanat). Augmentin terbukti telah berhasil mengatasi infeksi bakteri pada saluran kemih dan kulit[8]. Asam klavulanat yng diproduksi dari hasil fermentasi Streptomyces clavuligerus memiliki kemampuan untuk menghambat sisi aktif enzim beta-laktamase sehingga menyebabkan enzim tersebut menjadi inaktif[9]. Beberapa jenis antibiotik beta-laktam (contohnya nafcillin) juga memiliki sifat resisten terhadap beta-laktamase karena memiliki rantai samping dengan letak khusus[2].
Referensi
- ^ Madigan MT, Martinko JM, (2000). Brock Biology of Microorganisms. Prentice Hall. ISBN 978-0-13-081922-2.
- ^ a b c Richard Schwalbe, Lynn Steele-Moore, Avery C. Goodwin (2007). Antimicrobial susceptibility testing protocols. CRC Press. ISBN 978-0824741006.
- ^ a b c d e f Steeve Giguère (2007). Antimicrobial therapy in veterinary medicine. Wiley-Blackwell. ISBN 978-0813806563.
- ^ Office of Technology Assessment Congress of United States (1995). Impacts of Antibiotic-Resistant Bacteria. Diane Publishing Co.
- ^ a b R. Fontana, P. Canepari, M. M. Lleò, G. Satta (1990). "Mechanisms of resistance of enterococci to beta-lactam antibiotics". European Journal of Clinical Microbiology & Infectious Diseases. 9 (2): 103–105. doi:10.1007/BF01963633.
- ^ a b Ṛuben Vardanyan, Victor J. Hruby (2006). Synthesis of essential drugs. Elsevier Science. ISBN 978-0444521668.
- ^ a b Sherry F. Queener, J. Alan Webber (1986). Beta-lactam antibiotics for clinical use. Informa Healthcare. ISBN 978-0824773861.
- ^ Tan TH, Tay L, Yeo M, Feng PH. "Augmentin (Amoxycillin and clavulanic acid) in the treatment of urinary tact infections and skin and soft tissue infections" (PDF). Singapore Medical Journal (SMJ): 299–302.
- ^ C. READING, M. COLE (1997). "Clavulanic Acid: a Beta-Lactamase-Inhibiting Beta-Lactam from Streptomyces clavuligerus". ANTIMICROBIAL AGENT8 AIM CHEMOTHERAPY7. 11 (5): 852–857.