Reaksi dehidrasi
Dalam kimia, reaksi dehidarsi biasanya didefinisikan sebagai reaksi yang melibatkan pelepasan air dari molekul yang bereaksi. Reaksi dehidrasi merupakan subset dari reaksi eliminasi. Karena gugus hidroksil (-OH) adalah gugus lepas yang buruk, pemberian katalis asam Brønsted sering kali membantu protonasi gugus hidroksil, menjadikannya gugus lepas yang baik, -OH2+.
Dalam kimia organik, terdapat banyak contoh reaksi dehidrasi:
- 2 R-OH → R-O-R + H2O
- Konversi alkohol menjadi alkena
- R-CH2-CHOH-R → R-CH=CH-R + H2O
- Konversi asam karboksilat menjadi anhidrida asam:
- 2 RCO2H → (RCO)2O + H2O
- RCONH2 → R-CN + H2O
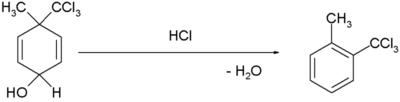
- Pada reaksi penataan ulang dienol benzena [1]:
Beberapa reaksi dehidrasi dapatlah berjalan dengan rumit. Sebagai contoh, reaksi gula dengan asam sulfat pekat [1] membentuk karbon melibatkan pembentukan ikatan karbon-karbon.[2]
- Gula (sukrosa) didehidrasi[3]:
- C12H22O11 + 98% Sulfuric acid → 12 C (graphitic foam) + 11 H2O steam + Sulfuric acid/water mixture
Reaksi ini didorong oleh reaksi eksotermik antara asam sulfat dengan air.
Agen dehidrasi yang umum meliputi asam sulfat pekat, asam fosfat pekat, aluminium oksida panas, keramik panas.
Lihat pula
Referensi
- ^ Margaret Jevnik Gentles, Jane B. Moss, Hershel L. Herzog, and E. B. Hershberg (1958). "The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione". J. Am. Chem. Soc. 80 (14): 3702–3705. doi:10.1021/ja01547a058.