Periode tabel periodik
Periode tabel periodik adalah satu baris horizontal pada tabel periodik. Dalam tabel periodik, unsur-unsur diatur dalam serangkaian baris (atau periode) sehingga mereka yang memiliki sifat-sifat serupa muncul dalam satu kolom. Unsur-unsur pada periode yang sama memiliki jumlah kulit elektron yang sama; dengan masing-masing perpotongan golongan di sepanjang periode, unsur memiliki satu tambahan proton dan elektron dan berkurang sifat logamnya. Pengaturan ini mencerminkan keberulangan sifat yang sama secara periodik seiring dengan kenaikan nomor atom. Misalnya, logam alkali terletak pada satu golongan (golongan 1) dan berbagi sifat yang mirip, seperti reaktivitas yang tinggi dan kecenderungan untuk kehilangan satu elektron agar sesuai dengan konfigurasi elektron gas mulia. Tabel periodik memiliki total 118 unsur.

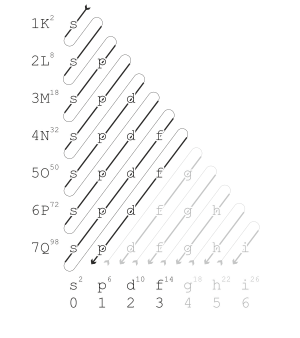
Mekanika kuantum modern menjelaskan tren periodik sifat-sifat dalam hal kulit elektron. Seiring dengan kenaikan nomor atom, kulit elektron terisi dengan elektron dengan urutan seperti ditunjukkan di sebelah kanan. Mengisi setiap kulit sesuai dengan baris dalam tabel.
Dalam blok-s dan blok-p tabel periodik, unsur-unsur dalam periode yang sama umumnya tidak menunjukkan tren dan kesamaan sifat (lebih signifikan tren vertikal ke bawah dalam golongan). Namun dalam blok-d, tren sepanjang periode menjadi signifikan, dan dalam blok-f, unsur-unsur menunjukkan tingkat kesamaan yang tinggi di sepanjang periode.
Periode
Tujuh periode unsur terjadi secara alami di Bumi. Untuk periode 8, yang mencakup unsur-unsur yang dapat disintesis setelah 2015, lihat tabel periodik panjang.
Sebuah golongan dalam kimia berarti famili objek dengan kesamaan seperti keluarga yang berbeda. Terdapat 7 periode, yang disusun horizontal di tabel periodik.
Periode 1
| Golongan | 1/17 | 2/18 |
|---|---|---|
| # Nama |
1 |
2 |
Periode pertama paling sedikit anggotanya, dengan hanya dua unsur, hidrogen dan helium. Oleh karena itu, mereka tidak mengikuti kaidah oktet. Secara kimia, helium berperilaku sebagai gas mulia, dan oleh karenanya dimasukkan sebagai bagian dari unsur golongan 18. Namun, dalam hal struktur intinya, helium masuk ke dalam blok s, dan oleh karena itu kadang-kadang diklasifikasikan ke dalam unsur golongan 2, atau secara simultan masuk ke dua golongan sekaligus golongan 2 dan 18. Hidrogen sangat mudah kehilangan dan menangkap sebuah elektron, dan oleh karena itu secara kimia masuk ke dalam dua golongan sekaligus yaitu unsur golongan 1 dan 17.
- Hidrogen (H) merupakan unsur paling melimpah, perhitungan kasar sekitar 75% dari massa unsur jagat raya.[1] Ion hidrogen hanyalah sebuah proton. Bintang dalam urutan utama sebagian besar tersusun dari hidrogen pada tingkat plasmanya. Unsur hidrogen relatif jarang di Bumi, dan secara industri diproduksi dari hidrokarbon seperti metana. Hidrogen dapat membentuk senyawa-senyawa dengan sebagian besar unsur dan terdapat dalam air serta sebagian besar senyawa organik.[2]
- Helium (He) hanya hadir dalam kondisi gas kecuali dalam kondisi ekstrem.[3] Ia merupakan unsur kedua terringan dan juga kedua yang paling melimpah di alam semesta.[4] Sebagian besar helium terbentuk selama Ledakan Dahsyat, tetapi helium baru tercipta melalui fusi nuklir hidrogen dalam bintang.[5] Di Bumi, helium relatif jarang, hanya muncul sebagai produk samping peluruhan alami beberapa unsur radioaktif.[6] Helium 'radiogenik' terperangkan di dalam gas alam dengan konsentrasi sampai dengan tujuh persen dari volume.[7]
Referensi
- ^ Palmer, David (November 13, 1997), Hydrogen in the Universe, NASA, diakses tanggal 2008-02-05
- ^ "hydrogen", Encyclopædia Britannica, 2008
- ^ "Helium: physical properties", WebElements, diakses tanggal 2008-07-15.
- ^ "Helium: geological information", WebElements, diakses tanggal 2008-07-15
- ^ Cox, Tony (1990-02-03), "Origin of the chemical elements", New Scientist, diakses tanggal 2008-07-15
- ^ "Helium supply deflated: production shortages mean some industries and partygoers must squeak by". Houston Chronicle. 2006-11-05.
- ^ Brown, David (2008-02-02). "Helium a New Target in New Mexico". American Association of Petroleum Geologists. Diakses tanggal 2008-07-15.