Bioekuivalensi
Bioekuivalensi atau kesetaraan hayati adalah istilah dalam farmakokinetika yang digunakan untuk menilai kesetaraan biologis dalam makhluk hidup (in vivo) dari dua produk obat. Jika dua produk dikatakan bioekuivalen, berarti dua produk tersebut diharapkan memiliki efek yang sama. Uji bioekuivalensi adalah uji untuk menentukan ekuivalensi antara obat generik dan obat paten yang dilakukan melalui uji in vivo atau in vitro. Subjek penelitiannya adalah orang sehat yang lolos pemeriksaan kesehatan meliputi tes urine, irama jantung, tensi normal, dan hemaglobin normal. Tujuannya adalah untuk memberikan jaminan kepada masyarakat bahwa obat paten dan obat generik yang beredar telah memenuhi standar keamanan, dan mutu yang disyaratkan. Tidak semua obat melalui uji ekuivalensi.[butuh rujukan]
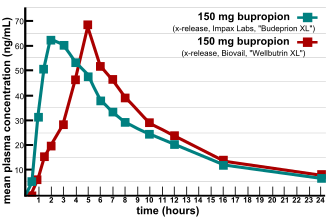
Birkett (2003) mendefinisikan bioekuivalensi dengan menyatakan bahwa, "dua produk obat dikatakan bioekuivalen jika produk tersebut ekuivalen farmaseutik dan bioavailabilitas setelah pemberian dalam dosis molar yang sama memiliki kemiripan yang sedemikian rupa hingga efeknya, seperti efikasi dan keamanan, dapat dikatakan sama. Ekuivalen farmaseutik berarti kedua obat tersebut memiliki zat aktif yang sama dengan jumlah yang sama, dalam bentuk sediaan yang sama, dengan cara pemberian yang sama, dan memenuhi standar yang sama atau sebanding."[1]
Menurut Organisasi Kesehatan Dunia (WHO), "dua produk obat dikatakan bioekuivalen jika produk tersebut ekuivalen farmaseutik atau alternatif farmaseutik (mengandung zat aktif yang sama tetapi berbeda dalam bentuk kimia (garam, ester, dan sebagainya) atau bentuk sediaan atau kekuatan) dan bioavailabilitasnya dalam hal laju penyerapan (kadar puncak (Cmax) dan waktu puncak (tmax)) serta tingkat penyerapan (area di bawah kurva atau area under the curve (AUC)) setelah pemberian dosis molar yang sama memiliki kemiripan yang sedemikian rupa sehingga efeknya pada dasarnya dapat dikatakan sama".[2]
Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) mendefinisikan bioekuivalensi sebagai, "tidak adanya perbedaan yang berarti dalam laju penyerapan dan kadar zat aktif dalam dua sediaan yang ekuivalen farmaseutik atau alternatif farmaseutik tersedia di lokasi kerja obat ketika diberikan dengan dosis molar dan keadaan yang sama dalam penelitian yang dirancang dengan tepat."[3]
Berdasarkan Badan Pengawas Obat dan Makanan (BPOM), "dua produk obat disebut bioekuivalen jika keduanya mempunyai ekuivalensi farmaseutik atau merupakan alternatif farmaseutik dan pada pemberian dengan dosis molar yang sama akan menghasilkan biovailabilitas yang sebanding sehingga efeknya akan sama, dalam hal efikasi maupun keamanan."[4]
Laboratorium yang Melakukan Uji Ekuivalensi
suntingBerikut ini adalah daftar laboratorium di Jabotabek yang melakukan uji ekuivalensi yaitu
- Equilab International
- Biometrik Riset Indonesia
- PT Clinisindo Laboratories
- Econolab International
- Omega Medika Farma Laboratory
- Equitrust Laboratory
Lihat juga
suntingRujukan
sunting- ^ Birkett DJ (2003). "Generics - equal or not?" (PDF). Aust Prescr. 26 (4): 85–7. doi:10.18773/austprescr.2003.063. Diarsipkan dari versi asli (PDF) tanggal 15 April 2013. Diakses tanggal 4 November 2013.
- ^ WHO Guidance for organizations performing in vivo bioequivalence studies. WHO Technical Report Series No. 996, 2016, Annex 9
- ^ Center for Drug Evaluation and Research (2003). "Guidance for Industry: Bioavailability and Bioequivalence Studies for Orally Administered Drug Products – General Considerations" (PDF). United States Food and Drug Administration.
- ^ Pedoman Uji Bioekivalensi (PDF). Jakarta: Badan Pengawas Obat dan Makanan. 2005. hlm. 2.
Pranala luar
sunting- Hussain AS, et al. The Biopharmaceutics Classification System: Highlights of the FDA's Draft Guidance Office of Pharmaceutical Science, Center for Drug Evaluation and Research, Food and Drug Administration.
- Rx index, specialized medical publication - online directory of drug bioequivalence. Intended exclusively for doctors of all specialties, pharmacists, clinical pharmacists, students of pharmaceutical faculties of higher medical (pharmaceutical) educational establishments of the III-IV level of accreditation, operators of the pharmaceutical market.
- Mills D (2005). Regulatory Agencies Do Not Require Clinical Trials To Be Expensive International Biopharmaceutical Association: IBPA Publications.
- FDA CDER Office of Generic Drugs – further U.S. information on bioequivalence testing and generic drugs
- Proposal to waive in vivo bioequivalence requirements for WHO Model List of Essential Medicines immediate-release, solid oral dosage forms. WHO Technical Report Series, No. 937, 2006, Annex 8.
- Guidance for organizations performing in vivo bioequivalence studies (revision). WHO Technical Report Series 996, 2016, Annex 9.
- General background notes and list of international comparator pharmaceutical products. WHO Technical Report Series 1003, 2017, Annex 5.
- WHO List of International Comparator products (September 2016)