Mikropeptida
Mikropeptida (juga disebut mikroprotein) adalah polipeptida dengan panjang kurang dari 100-150 asam amino yang disandi oleh rangka baca terbuka pendek (short open reading frame, sORF).[1][2][3] Dalam hal ini, mikropeptida berbeda dari banyak polipeptida kecil aktif lainnya, yang diproduksi melalui pembelahan pascatranslasional dari polipeptida yang lebih besar.[1][4] Dalam hal ukuran, mikropeptida jauh lebih pendek daripada protein "kanonik", yang memiliki panjang rata-rata 330 dan 449 asam amino dalam prokariota dan eukariota secara berturut-turut.[5] Mikropeptida kadang-kadang dinamai sesuai dengan lokasi genomiknya. Misalnya, produk translasi dari rangka baca terbuka hulu (upstream open reading frame, uORF) dapat disebut peptida yang disandi uORF (uORF-encoded peptide, uPEP).[6] Mikropeptida tidak memiliki urutan pensinyalan terminal-N, yang menunjukkan bahwa mikropeptida cenderung terlokalisasi di sitoplasma.[1] Namun, beberapa mikropeptida telah ditemukan di kompartemen sel lain, seperti yang ditunjukkan oleh keberadaan mikropeptida transmembran.[7][8] Mikropeptida dapat ditemukan dalam prokariota dan eukariota.[1][9][10] sORF yang menjadi asal mikropeptida yang ditranslasi dapat disandi dalam 5' UTR, gen kecil, atau mRNA polisistronik. Beberapa gen penyandi mikropeptida pada awalnya dianotasi secara salah sebagai RNA non-penyandi panjang (long non-coding RNA, lncRNA).[11]
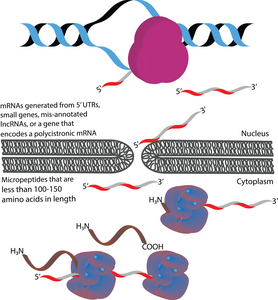
Karena ukurannya yang kecil, sORF pada awalnya diabaikan. Namun, ratusan ribu mikropeptida diduga telah diidentifikasi melalui berbagai teknik pada banyak organisme. Hanya sebagian kecil dari ini dengan potensi penyandian yang memiliki ekspresi dan fungsi yang dikonfirmasi. Mikropeptida yang telah dikarakterisasi secara fungsional, secara umum, memiliki peran dalam pensinyalan sel, organogenesis, dan fisiologi seluler. Semakin banyak mikropeptida yang ditemukan, semakin banyak fungsinya. Salah satu fungsi regulasi adalah fungsi peptoswitch, yang menghambat ekspresi urutan penyandi hilir dengan menghentikan ribosom, melalui aktivasi langsung atau tidak langsung oleh molekul kecil.[11]
Referensi
sunting
Versi bertanggal 2018 dari artikel ini telah melewati proses ulasan sejawat (di sini), telah dimuat dalam jurnal PLOS Genetics dan dapat dirujuk sebagai: Sousa M, Farkas M (2018). "Micropeptide". PLOS Genetics. 14 (12): e1007764. doi:10.1371/journal.pgen.1007764. |
- ^ a b c d Crappé J, Van Criekinge W, Menschaert G (2014). "Little things make big things happen: A summary of micropeptide encoding genes". EuPA Open Proteomics. 3: 128–137. doi:10.1016/j.euprot.2014.02.006.
- ^ Makarewich CA, Olson EN (September 2017). "Mining for Micropeptides". Trends in Cell Biology. 27 (9): 685–696. doi:10.1016/j.tcb.2017.04.006. PMC 5565689 . PMID 28528987.
- ^ Guillén G, Díaz-Camino C, Loyola-Torres CA, Aparicio-Fabre R, Hernández-López A, Díaz-Sánchez M, Sanchez F (2013). "Detailed analysis of putative genes encoding small proteins in legume genomes". Frontiers in Plant Science. 4: 208. doi:10.3389/fpls.2013.00208. PMC 3687714 . PMID 23802007.
- ^ Hashimoto Y, Kondo T, Kageyama Y (June 2008). "Lilliputians get into the limelight: novel class of small peptide genes in morphogenesis". Development, Growth & Differentiation. 50 Suppl 1: S269–76. doi:10.1111/j.1440-169x.2008.00994.x. PMID 18459982.
- ^ Zhang J (March 2000). "Protein-length distributions for the three domains of life". Trends in Genetics. 16 (3): 107–9. doi:10.1016/s0168-9525(99)01922-8. PMID 10689349.
- ^ Rothnagel J, Menschaert G (May 2018). "Short Open Reading Frames and Their Encoded Peptides". Proteomics. 18 (10): e1700035. doi:10.1002/pmic.201700035. PMID 29691985.
- ^ Anderson DM, Anderson KM, Chang CL, Makarewich CA, Nelson BR, McAnally JR, Kasaragod P, Shelton JM, Liou J, Bassel-Duby R, Olson EN (February 2015). "A micropeptide encoded by a putative long noncoding RNA regulates muscle performance". Cell. 160 (4): 595–606. doi:10.1016/j.cell.2015.01.009. PMC 4356254 . PMID 25640239.
- ^ Bi P, Ramirez-Martinez A, Li H, Cannavino J, McAnally JR, Shelton JM, Sánchez-Ortiz E, Bassel-Duby R, Olson EN (April 2017). "Control of muscle formation by the fusogenic micropeptide myomixer". Science. 356 (6335): 323–327. doi:10.1126/science.aam9361. PMC 5502127 . PMID 28386024.
- ^ Alix E, Blanc-Potard AB (February 2008). "Peptide-assisted degradation of the Salmonella MgtC virulence factor". The EMBO Journal. 27 (3): 546–57. doi:10.1038/sj.emboj.7601983. PMC 2241655 . PMID 18200043.
- ^ Burkholder WF, Kurtser I, Grossman AD (January 2001). "Replication initiation proteins regulate a developmental checkpoint in Bacillus subtilis". Cell. 104 (2): 269–79. doi:10.1016/s0092-8674(01)00211-2. PMID 11207367.
- ^ a b Andrews SJ, Rothnagel JA (March 2014). "Emerging evidence for functional peptides encoded by short open reading frames". Nature Reviews. Genetics. 15 (3): 193–204. doi:10.1038/nrg3520. PMID 24514441.