Wolframat
Dalam kimia, wolframat atau tungstat adalah senyawa yang mengandung oksoanion (ion oksida) dari wolfram atau oksida campuran yang mengandung wolfram. Ion wolframat yang paling sederhana adalah WO2−4, "ortowolframat".[1] Banyak wolframat lain yang termasuk dalam kelompok besar ion poliatomik yang disebut polioksometalat (POM), dan secara khusus disebut isopolioksometalat karena mengandung, bersama dengan oksigen dan mungkin hidrogen, hanya satu unsur lainnya. Hampir semua bijih wolfram yang berguna adalah wolframat.[2]
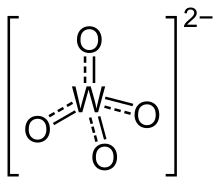
Struktur sunting
Ortowolframat memiliki pusat tetrahedral W(VI) dengan jarak W–O yang pendek, sekitar 1,79 Å. Secara struktural, mereka menyerupai sulfat. Wolfram oktahedral berligan enam merupakan struktur yang melimpah di polioksowolframat. Dalam senyawa tersebut, jarak W–O lebih panjang.[1]
Beberapa contoh dari ion wolframat:[3]
- HWO−4 (ion hidrogen wolframat)[3]
- ion polimer W2O2−7 dari berbagai struktur pada Na2W2O7, Li2W2O7 dan Ag2W2O7[4]
- [W7O24]6− (parawolframat A)[3]
- [W10O32]4− (wolframat Y)[5]
- [H2W12O42]10− (parawolframat B)[3]
- α-[H2W12O40]6− (metawolframat)[5]
- β-[H2W12O40]6− (wolframat X)[5]
Lihat kategori wolframat untuk melihat daftar wolframat.
Keberadaan sunting
Wolframat muncul secara alami dengan molibdat. Skelit, mineral dari kalsium wolframat, sering mengandung sejumlah kecil molibdat. Wolframit adalah campuran mangan dan besi wolframat, dan semuanya merupakan sumber wolfram yang berharga. Powelit adalah bentuk mineral dari kalsium molibdat yang mengandung sedikit wolframat.
Reaksi sunting
Larutan wolframat, seperti molibdat, menghasilkan larutan biru berisi kompleks wolframat(V, VI) yang analog dengan molibdenum biru ketika direduksi oleh sebagian besar bahan organik.[1]
Tidak seperti kromat, wolframat bukan oksidator yang baik, tetapi seperti kromat, larutan wolframat diembunkan untuk menghasilkan isopoliwolframat pada proses pengasaman.
Referensi sunting
- ^ a b c Egon Wiberg, Arnold Frederick Holleman (2001). Inorganic Chemistry. Elsevier. ISBN 0-12-352651-5.
- ^ Erik Lassner, Wolf-Dieter Schubert, Eberhard Lüderitz, Hans Uwe Wolf "Tungsten, Tungsten Alloys, and Tungsten Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2000, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a27_229
- ^ a b c d Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ a b c Jon A. McCleverty, N. G. Connelly,Nomenclature of inorganic chemistry II: recommendations 2000, International Union of Pure and Applied Chemistry Commission on the Nomenclature of Inorganic Chemistry, Published by Royal Society of Chemistry, 2001, ISBN 0-85404-487-6