Magnesium bikarbonat
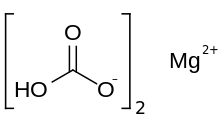
Magnesium bikarbonat atau magnesium hidrogen karbonat, Mg(HCO3)2, adalah garam bikarbonat dari magnesium. Senyawa ini dapat dibentuk melalui reaksi larutan encer asam karbonat (seperti air soda) dan magnesium hidroksida (susu magnesium).[1]
| |
| Nama | |
|---|---|
| Nama IUPAC
Magnesium hidrogen karbonat
| |
| Nama lain
Magnesium bikarbonat
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| Mg(HCO3)2 | |
| Massa molar | 146.34 g/mol |
| 0.077 g / (100 mL) | |
| Senyawa terkait | |
Kation lainnya
|
Kalsium bikarbonat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Preparasi
Senyawa ini dapat dibuat melalui sintesis magnesium asetat dan natrium bikarbonat.
- Mg(CH3COO)2 + 2NaHCO3 → Mg(HCO3)2 + 2CH3COONa
Magnesium bikarbonat hanya terdapat dalam larutan berair. Magnesium tidak membentuk bikarbonat padat seperti Litium. Untuk memproduksinya, suspensi magnesium hidroksida diperlakukan dengan karbon dioksida bertekanan, menghasilkan larutan magnesium bikarbonat:[2]
- Mg(OH)2 + 2 CO2 → Mg(HCO3)2
Pengeringan larutan yang dihasilkan menyebabkan magnesium bikarbonat menjadi terurai, menghasilkan magnesium karbonat, karbon dioksida, dan air:[3]
- Mg2+ + 2 HCO3− → MgCO3 + CO2 + H2O
Kegunaan
Magnesium bikarbonat memiliki banyak manfaat kesehatan dan digunakan untuk menahan perubahan pH darah dan menjaganya dalam rentang yang optimal.[4]
Sebagai mineral penting, senyawa ini membantu dalam pengaturan tekanan darah, sintesis protein, fungsi saraf dan otot, dan kontrol glukosa darah dalam tubuh manusia.[4][5]
Senyawa ini digunakan sebagai aditif makanan seperti pengatur keasaman, kebasaan, anti-retak dan bahan pemutih.[6]
Lihat pula
Referensi
- ^ Cheremisinoff, Nicholas P. (1994). Handbook of Water and Wastewater Treatment Technology (dalam bahasa Inggris). Boca Raton, FL: CRC Press. hlm. 54. ISBN 0824792777.
- ^ Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman (2005), "Magnesium Compounds", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a15_595.pub2
- ^ Wilson, W., McKiel, M., Gear, J., & MacClaren, R. (1978). "Preparation of Solutions of Magnesium Bicarbonate for Deacidification". The American Archivist. 41 (1): 67–70.
- ^ a b "Magnesium Bicarbonate Water – The importance of bicarbonates and magnesium". Dancing with Water (dalam bahasa Inggris). Diakses tanggal 6 Agustus 2019.
- ^ Splane, Lily (2002). Nutritional Self-Defense: Better Health in a Polluted, Over-Processed, and Stressful World (dalam bahasa Inggris). Anaphase II Publishing. hlm. 47. ISBN 0945962134.
- ^ M. Hanssen (1987). E for Additives (dalam bahasa Inggris). Wellingborough, Northants, UK: Thorsons Publishers Limited. ISBN 0722511507.