Diklorin heptoksida
Diklorin heptoksida adalah senyawa kimia dengan rumus Cl2O7. Oksida klorin ini merupakan anhidrida dari asam perklorat. Senyawa ini dihasilkan dari distilasi asam perklorat secara hati-hati dengan adanya agen pendehidrasi fosfor pentoksida:[2]

| |
| |
| Nama | |
|---|---|
| Nama IUPAC
Diklorin heptoksida
| |
| Nama lain
Klorin(VII) oksida; Perklorat anhidrida; (Perkloroksi)klorana trioksida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| Cl2O7 | |
| Massa molar | 182.901 g/mol |
| Penampilan | cairan tak berwarna |
| Densitas | 1.9 g/cm3 |
| Titik lebur | −9.157 °C (−16.451 °F; −8.884 K) |
| Titik didih | 82 °C (180 °F; 355 K) |
| terhidrolisis membentuk asam perklorat | |
| Bahaya | |
| Bahaya utama | pengoksidasi, bahan peledak kontak[1] |
| Senyawa terkait | |
Senyawa terkait
|
Mangan heptoksida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
- 2 HClO4 + P4O10 → Cl2O7 + H2P4O11
Klorin(VII) oksida dapat didistilasi keluar dari campuran.
Senyawa ini dapat pula dibentuk melalui iluminasi campuran klorin dan ozon.[3] Senyawa ini terhidrolisis secara lambat kembali menjadi asam perklorat, yang berbahaya ketika dalam bentuk anhidratnya.[1]
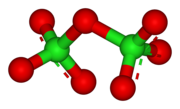
Struktur
Cl2O7 adalah molekul endergonik, yang berarti secara intrinsik tidak stabil, terurai menjadi unsur-unsur penyusunnya dengan pelepasan energi:[4]
- 2 Cl2O7 → 2 Cl2 + 7 O2 (ΔH° = –132 kkal/mol)
Cl2O7 memiliki bentuk tekuk dengan sudut Cl−O−Cl sebesar 118.6° yang membuat simetri molekul ini adalah C2. Jarak ujung Cl−O adalah 1.709 Å dan jarak Cl=O adalah 1.405 Å.[1] Dalam senyawa ini, klorin ada dalam keadaan oksidasi formal tertinggi yaitu +7, meskipun ikatan dalam molekul ini secara signifikan bersifat kovalen.[5]
Sifat kimia
Diklorin heptoksida bereaksi dengan amina primer dan sekunder dalam larutan karbon tetraklorida untuk menghasilkan amida perklorat:[6]
- 2 RNH2 + Cl2O7 → 2 RNHClO3 + H2O
- 2 R2NH + Cl2O7 → 2 R2NClO3 + H2O
Senyawa ini juga bereaksi dengan alkena untuk menghasilkan alkil perklorat. Misalnya, ia bereaksi dengan propena dalam larutan karbon tetraklorida untuk menghasilkan isopropil perklorat dan 1-kloro-2-propil perklorat.[7]
Diklorin heptoksida bereaksi dengan alkohol membentuk alkil perklorat.[8]
Diklorin heptoksida adalah oksida asam kuat, dan dalam larutan membentuk kesetimbangan dengan asam perklorat.[1]
Keamanan
Walaupun senyawa ini merupakan oksida klorin yang paling stabil, Cl2O7 adalah pengoksidasi kuat serta bahan peledak yang dapat meledak dengan nyala api atau kejutan mekanis, atau melalui kontak dengan yodium.[9] Namun demikian, senyawa ini kurang kuat mengoksidasi dibandingkan oksida klorin lainnya, dan tidak menyerang sulfur, fosfor, atau kertas saat dingin.[1] Senyawa ini memiliki efek yang sama pada tubuh manusia sebagai unsur klorin, dan membutuhkan tindakan pencegahan yang sama.[10]
Referensi
- ^ a b c d e Holleman, Arnold F.; Wiberg, Egon (2001). Inorganic chemistry (dalam bahasa Inggris). Diterjemahkan oleh Mary Eagleson; William Brewer. San Diego: Academic Press. hlm. 464. ISBN 0-12-352651-5.
- ^ Smith, G. Frederick (1953). "The Preparation of Anhydrous Perchloric Acid". J. Am. Chem. Soc. (dalam bahasa Inggris). 75 (1): 184–186. doi:10.1021/ja01097a048.
- ^ Byrns, A. C.; Rollefson, G. K. (1934). "The Formation of Chlorine Heptoxide on Illumination of Mixtures of Chlorine and Ozone". Journal of the American Chemical Society (dalam bahasa Inggris). 56 (5): 1250–1251. doi:10.1021/ja01320a506.
- ^ Martin, Jan M. L (12 Oktober 2006). "Heats of formation of perchloric acid, HClO4, and perchloric anhydride, Cl2O7. Probing the limits of W1 and W2 theory". Journal of Molecular Structure: THEOCHEM. Modelling Structure and Reactivity: the 7th triennial conference of the World Association of Theoritical and Computational Chemists (WATOC 2005) (dalam bahasa Inggris). 771 (1): 19–26. arXiv:physics/0508076 . doi:10.1016/j.theochem.2006.03.035. ISSN 0166-1280.
- ^ Ropp, R.C. (2013). "Chapter 2 - Group 17 (H, F, Cl, Br, I) Alkaline Earth Compounds". Encyclopedia of the Alkaline Earth Compounds. Elsevier: 25–104. doi:10.1016/B978-0-444-59550-8.00002-8. ISBN 9780444595508.
- ^ Beard, C. D.; Baum, K. (1974). "Reactions of dichlorine heptoxide with amines". Journal of the American Chemical Society (dalam bahasa Inggris). 96 (10): 3237–3239. doi:10.1021/ja00817a034.
- ^ Baum, K. (1976). "Reactions of dichlorine heptoxide with olefins". The Journal of Organic Chemistry (dalam bahasa Inggris). 41 (9): 1663–1665. doi:10.1021/jo00871a048.
- ^ Baum, Kurt; Beard, Charles D. (1974). "Reactions of dichlorine heptoxide with alcohols". J. Am. Chem. Soc. (dalam bahasa Inggris). 96 (10): 3233–3237. doi:10.1021/ja00817a033.
- ^ Lewis, Robert Alan (1998). Lewis' dictionary of toxicology (dalam bahasa Inggris). CRC Press. hlm. 260. ISBN 1-56670-223-2.
- ^ Jeanne Mager Stellman, ed. (1998). "Halogens and their compounds". Encyclopaedia of occupational health and safety (dalam bahasa Inggris) (edisi ke-4). International Labour Organization. hlm. 104.210. ISBN 92-2-109817-6.