Hidrogen sianida
senyawa kimia
(Dialihkan dari Asam hidrosianat)
Hidrogen sianida (HCN) (juga dikenal sebagai Asam Sianida) adalah senyawa anorganik[6] dengan rumus molekul HCN. Senyawa ini berbentuk cairan tak berwarna, dan sangat beracun, dengan titik didih sedikit di atas suhu ruangan, 25,6 °C (78,1 °F).[7] HCN diproduksi dalam skala industri dan sangat bernilai karena digunakan sebagai bahan baku banyak senyawa kimia mulai polimer sampai obat-obatan.
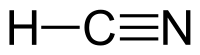
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC | |||
Nama lain
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
| MeSH | Hydrogen+Cyanide | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
| Nomor UN | 1051 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| CHN | |||
| Massa molar | 27,03 g·mol−1 | ||
| Penampilan | Cairan transparan atau gas tak berwarna | ||
| Bau | Minyak dari almond pahit | ||
| Densitas | 0.687 g mL−1 | ||
| Bercampur | |||
| Kelarutan dalam etanol | Miscible | ||
| kH | 75 μmol Pa−1 kg−1 | ||
| Keasaman (pKa) | 9.21[3] | ||
| Kebasaan (pKb) | 4.79 | ||
| Indeks bias (nD) | 1.2675 [4] | ||
| Viskositas | 201 μPa s | ||
| Struktur | |||
| Linear | |||
| 2.98 D | |||
| Termokimia | |||
| Kapasitas kalor (C) | 71.00 kJ K−1 mol−1 (at 27 °C)[5] | ||
| Entropi molar standar (S |
113.01 J K−1 mol−1 | ||
| Entalpi pembentukan standar (ΔfH |
109.9 kJ mol−1 | ||
| Entalpi pembakaran standar ΔcH |
-426.5 kJ mol−1 | ||
| Bahaya | |||
Klasifikasi UE (DSD) (usang)
|
|||
| Frasa-R | R12, R26/27/28, R50/53 | ||
| Frasa-S | (S1/2), S16, S36/37, S38, S45, S53, S59, S61 | ||
| Titik nyala | −178 °C (−288,4 °F; 95,1 K) | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Referensi
sunting- ^ "Hydrogen Cyanide - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004. Identification. Diakses tanggal 2012-06-04.
- ^ "hydrogen cyanide (CHEBI:18407)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 18 October 2009. Main. Diakses tanggal 2012-06-04.
- ^ Perrin, D. D. (1982). Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution (edisi ke-2nd). Oxford: Pergamon Press.
- ^ Patnaik, P. (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ^ NIST Chemistry WebBook
- ^ Gail, E.; Gos, S.; Kulzer, R.; Lorösch, J.; Rubo, A.; Sauer, M. (2005), "Cyano Compounds, Inorganic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a08_159.pub2
- ^ http://www.wolframalpha.com/input/?i=boiling+point+of+Hydrogen+cyanide
Pranala luar
sunting- Institut national de recherche et de sécurité (1997). "Cyanure d'hydrogène et solutions aqueuses Diarsipkan 2006-02-20 di Wayback Machine.". Fiche toxicologique n° 4, Paris:INRS, 5pp. (PDF file, in French)
- International Chemical Safety Card 0492
- Hydrogen cyanide and cyanides (CICAD 61)
- National Pollutant Inventory: Cyanide compounds fact sheet Diarsipkan 2006-05-17 di Wayback Machine.
- NIOSH Pocket Guide to Chemical Hazards
- Department of health review Diarsipkan 2011-06-07 di Wayback Machine.

