Asam selenit
senyawa kimia
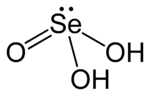
Asam selenit adalah senyawa kimia dengan rumus H2SeO3. Jika dilihat dari strukturnya, rumus kimia yang lebih tepat adalah (HO)2SeO.
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Asam selenit
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
| KEGG | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| H2SeO3 | |
| Massa molar | 128.97 g/mol |
| Penampilan | kristal higroskopik putih |
| Densitas | 3.0 g/cm3 |
| Titik lebur | berdekomposisi pada suhu 70 °C |
| sangat dapat larut | |
| Kelarutan | dapat larut dalam etanol |
| Keasaman (pKa) | 2.46, 7.3[2] |
| −45.4·10−6 cm3/mol | |
| Senyawa terkait | |
Anion lain
|
asam selenat hidrogen selenida |
Kation lainnya
|
natrium selenit |
Senyawa terkait
|
asam sulfit asal telurit asam polonit |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Pembentukan dan properti
suntingAsam selenit analog dengan asam sulfit, tetapi asam ini lebih mudah diisolasi. Asam selenit dapat dibentuk dengan menambahkan selenium dioksida ke dalam air. Di dalam larutan asam ini merupakan asam diprotik:[3]
- H2SeO3 H+ + HSeO−3 (pKa = 2.62)
- HSeO−3 H+ + SeO2−3 (pKa = 8.32)
Asam ini tergolong sebagai oksidator, tetapi secara kinetis berlangsung lamban. Dalam 1 M H+:
- H2SeO3 + 4 H+ + 4 e− Se + 3 H2O (E
o= +0.74 V)
Dalam 1 M OH−:
- SeO2−3 + 4 e− + 3 H2O Se + 6 OH− (E
o= −0.37 V)
Asam ini digunakan dalam proses sintesis organik untuk menyintesiskan 1,2-diketone.[4]
Kegunaan
suntingKegunaan utamanya adalah dalam melindungi dan mengubah warna baja, khususnya baja di senjata api.[5]
Referensi
sunting- ^ Lide, David R. (1998). Handbook of Chemistry and Physics (edisi ke-87). Boca Raton, FL: CRC Press. hlm. 4–81. ISBN 0-8493-0594-2.
- ^ Ka and pKa for Polyprotic Acids. ucdsb.on.ca
- ^ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ^ “Glyoxal Bisulfite”, Organic Syntheses, Collected Volume 3, hlm. 438 (1955).
- ^ Scarlato, E.A.; Higa, J. (28 June 1990). USES/HIGH RISK CIRCUMSTANCES OF POISONING "SELENIUM" Periksa nilai
|url=(bantuan). Diakses tanggal 29 December 2010.