Dikalsium fosfat
Dikalsium fosfat adalah kalsium fosfat dengan rumus CaHPO4 dan dihidratnya. Awalan "di" pada nama umum muncul karena pembentukan anion HPO42– melibatkan penghilangan dua proton dari asam fosfat, H3PO4. Ia juga dikenal sebagai kalsium fosfat dibasik atau kalsium monohidrogen fosfat. Dikalsium fosfat digunakan sebagai bahan tambahan pangan, ditemukan di beberapa pasta gigi sebagai bahan pemoles, dan merupakan biomaterial.[1][2]
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
kalsium hidrogen fosfat
| |
| Nama lain
kalsium hidrogen fosfat,
garam kalsium asam fosforat (1:1) | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| CaHPO4 | |
| Massa molar | 136.06 g/mol (anhidrat) 172.09 (dihidrat) |
| Penampilan | serbuk putih |
| Bau | tak berbau |
| Densitas | 2.929 g/cm3 (anhidrat) 2.31 g/cm3 (dihidrat) |
| Titik lebur | terurai |
| 0.02 g/100 mL (anhidrat) 0.02 g/100 mL (dihidrat) | |
| Struktur | |
| triklinik | |
| Bahaya | |
| Titik nyala | Tidak mudah terbakar |
| Senyawa terkait | |
Anion lain
|
Kalsium pirofosfat |
Kation lainnya
|
Magnesium fosfat Monokalsium fosfat Trikalsium fosfat Stronsium fosfat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Preparasi
suntingDikalsium fosfat dihasilkan melalui netralisasi kalsium hidroksida dengan asam fosfat, yang mengendapkan dihidrat sebagai padatan. Pada suhu 60 °C bentuk anhidrat diendapkan:[3]
Untuk mencegah degradasi yang akan membentuk hidroksiapatit, natrium pirofosfat atau trimagnesium fosfat oktahidrat ditambahkan ketika, misalnya, kalsium fosfat dihidrat dibasik akan digunakan sebagai bahan pemoles dalam pasta gigi.[1]
Dalam proses berkelanjutan CaCl2 dapat diolah dengan (NH4)2HPO4 untuk membentuk dihidrat:
Bubur dihidrat kemudian dipanaskan hingga sekitar 65–70 °C untuk membentuk CaHPO4 anhidrat sebagai endapan kristal, biasanya berbentuk kristal intan datar, yang cocok untuk diproses lebih lanjut.[butuh rujukan]
DiKalsium fosfat dihidrat dibasik dibentuk dalam semen kalsium fosfat, yang memiliki aplikasi medis. Contoh reaksi pengaturan keseluruhan dalam pembentukan semen kalsium fosfat "β-TCP/MCPM" (β-trikalsium fosfat/monokalsium fosfat) adalah:[4]
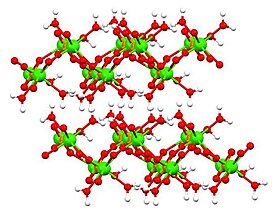
Struktur
suntingTiga bentuk dikalsium fosfat diketahui:
- dihidrat, CaHPO4•2H2O ('DCPD'), mineral brusit
- monohidrat, CaHPO4•H2O ('DCPM') CaHPO4
- anhidrat, CaHPO4 ('DCPA'), mineral monetit. Di bawah pH 4,8 bentuk dikalsium fosfat dihidrat dan anhidrat adalah kalsium fosfat yang paling stabil (tidak larut).
Struktur bentuk anhidrat dan dihidrat telah ditentukan dengan kristalografi sinar-X dan struktur monohidrat ditentukan dengan kristalografi elektron. Dihidrat[5] (ditunjukkan pada tabel di atas) dan juga monohidrat[6] mengadopsi struktur berlapis.
Kegunaan
suntingDikalsium fosfat terutama digunakan sebagai suplemen makanan dalam sereal sarapan siap saji, makanan anjing, tepung yang diperkaya, dan produk mie. Senyawa ini juga digunakan sebagai bahan tablet dalam beberapa sediaan farmasi, termasuk beberapa produk yang dimaksudkan untuk menghilangkan bau badan. Dikalsium fosfat juga ditemukan di beberapa suplemen kalsium makanan. Senyawa ini juga digunakan dalam pakan unggas. Senyawa ini juga digunakan dalam beberapa pasta gigi sebagai agen pengontrol karang gigi.[7]
Pemanasan dikalsium fosfat menghasilkan dikalsium difosfat, suatu bahan pemoles yang berguna:
Dalam bentuk dihidrat (brusit) ditemukan di beberapa batu ginjal dan batu gigi.[8][3]
Referensi
sunting- ^ a b Corbridge, D. E. C. (1995). "Phosphates". Phosphorus - an Outline of its Chemistry, Biochemistry and Uses. Studies in Inorganic Chemistry. 20. hlm. 169–305. doi:10.1016/B978-0-444-89307-9.50008-8. ISBN 9780444893079.
- ^ Salinas, Antonio J.; Vallet-Regí, María (2013). "Bioactive ceramics: From bone grafts to tissue engineering". RSC Advances. 3 (28): 11116. Bibcode:2013RSCAd...311116S. doi:10.1039/C3RA00166K.
- ^ a b Rey, C.; Combes, C.; Drouet, C.; Grossin, D. (2011). "Bioactive Ceramics: Physical Chemistry". Comprehensive Biomaterials. hlm. 187–221. doi:10.1016/B978-0-08-055294-1.00178-1. ISBN 9780080552941.
- ^ Tamimi, Faleh; Sheikh, Zeeshan; Barralet, Jake (2012). "Dicalcium phosphate cements: Brushite and monetite". Acta Biomaterialia. 8 (2): 474–487. doi:10.1016/j.actbio.2011.08.005. PMID 21856456.
- ^ Curry, N. A.; Jones, D. W. (1971). "Crystal structure of brushite, calcium hydrogen orthophosphate dihydrate: A neutron-diffraction investigation". Journal of the Chemical Society A: Inorganic, Physical, Theoretical: 3725. doi:10.1039/J19710003725.
- ^ Lu, Bing-Qiang; Willhammar, Tom; Sun, Ben-Ben; Hedin, Niklas; Gale, Julian D.; Gebauer, Denis (2020-03-24). "Introducing the crystalline phase of dicalcium phosphate monohydrate". Nature Communications (dalam bahasa Inggris). 11 (1): 1546. Bibcode:2020NatCo..11.1546L. doi:10.1038/s41467-020-15333-6. ISSN 2041-1723. PMC 7093545 . PMID 32210234.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Phosphoric Acid and Phosphates". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a19_465.pub3. ISBN 978-3527306732.
- ^ Pak, Charles Y.C.; Poindexter, John R.; Adams-Huet, Beverley; Pearle, Margaret S. (2003). "Predictive value of kidney stone composition in the detection of metabolic abnormalities". The American Journal of Medicine. 115 (1): 26–32. doi:10.1016/S0002-9343(03)00201-8. PMID 12867231.