Einsteinium
Einsteinium adalah sebuah unsur kimia sintetis dengan lambang Es dan nomor atom 99. Einsteinium adalah salah satu anggota deret aktinida dan merupakan unsur transuranium ketujuh. Unsur ini dinamai untuk menghormati Albert Einstein.
99Es Einsteinium | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
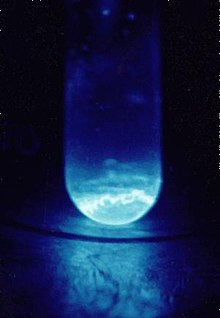 Einsteinium padat berbobot 300 μg di dalam botol berdiameter 9 mm. Cahaya biru berasal dari ionisasi udara akibat partikel alfa | ||||||||||||||||||||||||||||||||||||||||
Garis spektrum einsteinium | ||||||||||||||||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /éinstéinium/[1] | |||||||||||||||||||||||||||||||||||||||
| Penampilan | keperakan; bersinar biru dalam gelap | |||||||||||||||||||||||||||||||||||||||
| Einsteinium dalam tabel periodik | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 99 | |||||||||||||||||||||||||||||||||||||||
| Golongan | golongan n/a | |||||||||||||||||||||||||||||||||||||||
| Periode | periode 7 | |||||||||||||||||||||||||||||||||||||||
| Blok | blok-f | |||||||||||||||||||||||||||||||||||||||
| Kategori unsur | aktinida | |||||||||||||||||||||||||||||||||||||||
| Nomor massa | [252] | |||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Rn] 5f11 7s2 | |||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 29, 8, 2 | |||||||||||||||||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | |||||||||||||||||||||||||||||||||||||||
| Titik lebur | 1133 K (860 °C, 1580 °F) | |||||||||||||||||||||||||||||||||||||||
| Titik didih | 1269 K (996 °C, 1825 °F) (diperkirakan) | |||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 8,84 g/cm3 | |||||||||||||||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | +2, +3, +4 | |||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,3 | |||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 619 kJ/mol | |||||||||||||||||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | sintetis | |||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat muka (fcc) | |||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik | |||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7429-92-7 | |||||||||||||||||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||||||||||||||||
| Penamaan | dari A. Einstein | |||||||||||||||||||||||||||||||||||||||
| Penemuan | Laboratorium Nasional Lawrence Berkeley (1952) | |||||||||||||||||||||||||||||||||||||||
| Isotop einsteinium yang utama | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
Einsteinium ditemukan sebagai komponen dari puing-puing ledakan bom hidrogen pertama pada tahun 1952. Isotopnya yang paling umum, einsteinium-253 (waktu paruh 20,47 hari), diproduksi secara artifisial dari peluruhan kalifornium-253 dalam beberapa reaktor nuklir berdaya tinggi dengan total hasil di urutan satu miligram per tahun. Sintesis reaktor diikuti oleh proses kompleks pemisahan einsteinium-253 dari aktinida lain dan produk peluruhannya. Isotop lain disintesis di berbagai laboratorium, tetapi dalam jumlah yang jauh lebih kecil, dengan membombardir unsur aktinida berat dengan ion ringan. Karena einsteinium hanya diproduksi dalam jumlah kecil dan waktu paruh pendek dari isotopnya yang paling mudah diproduksi, saat ini hampir tidak ada aplikasi praktis untuk unsur ini di luar penelitian ilmiah dasar. Secara khusus, einsteinium digunakan untuk menyintesis, untuk pertama kalinya, 17 atom unsur baru mendelevium pada tahun 1955.
Einsteinium adalah logam paramagnetik yang lunak dan berwarna keperakan. Sifat kimianya merupakan sifat khas dari aktinida akhir, dengan bilangan oksidasi +3 yang lebih besar; bilangan oksidasi +2 juga dapat diakses, terutama dalam padatan. Radioaktivitas einsteinium-253 yang tinggi menghasilkan cahaya yang terlihat dan dengan cepat merusak kisi logam kristalnya, dengan panas yang dilepaskan sekitar 1000 watt per gram. Kesulitan dalam mempelajari sifat-sifatnya adalah karena einsteinium-253 meluruh menjadi berkelium-249 dan kemudian kalifornium-249 dengan laju sekitar 3% per hari. Isotop einsteinium dengan waktu paruh terpanjang, einsteinium-252 (waktu paruh 471,7 hari) akan lebih cocok untuk penyelidikan sifat fisik, tetapi telah terbukti jauh lebih sulit untuk diproduksi dan hanya tersedia dalam jumlah kecil, dan tidak dalam jumlah besar.[2] Einsteinium adalah unsur dengan nomor atom tertinggi yang telah diamati dalam jumlah makroskopis dalam bentuk murni, dan ini adalah isotop umum einsteinium-253 yang berumur pendek.[3]
Seperti semua unsur transuranium sintetis, isotop einsteinium sangatlah radioaktif dan dianggap sangat berbahaya bagi kesehatan jika tertelan.[4]
Sejarah
suntingEinsteinium pertama kali diidentifikasi pada bulan Desember 1952 oleh Albert Ghiorso dan rekan kerjanya di Universitas California, Berkeley yang bekerja sama dengan Laboratorium Nasional Argonne dan Los Alamos, sebagai dampak dari uji coba nuklir Ivy Mike. Uji coba ini dilakukan pada tanggal 1 November 1952, di Atol Enewetak di Samudra Pasifik dan merupakan uji senjata termonuklir pertama yang berhasil dilakukan.[5] Pemeriksaan awal puing-puing dari ledakan telah menunjukkan produksi isotop plutonium baru, 244
94Pu, yang hanya dapat terbentuk dengan penyerapan enam neutron oleh inti uranium-238 diikuti oleh dua peluruhan beta.
Pada saat itu, penyerapan neutron ganda dianggap sebagai proses yang sangat langka, tetapi identifikasi 244
94Pu menunjukkan bahwa masih lebih banyak lagi neutron yang dapat ditangkap oleh inti uranium, sehingga menghasilkan unsur-unsur baru yang lebih berat daripada kalifornium.[5]
Ghiorso dan rekan kerjanya menganalisis kertas saring yang telah diterbangkan melalui awan ledakan di pesawat terbang (teknik pengambilan sampel yang sama yang telah digunakan untuk menemukan 244
94Pu).[6] Sejumlah besar bahan radioaktif kemudian diisolasi dari puing-puing karang atol, yang kemudian dikirim ke A.S.[5] Pemisahan unsur baru yang dicurigai dilakukan dengan adanya larutan penyangga asam sitrat/amonium dalam media asam lemah (pH ≈ 3,5), menggunakan pertukaran ion pada suhu tinggi; kurang dari 200 atom einsteinium ditemukan pada akhirnya.[7] Namun demikian, unsur 99 (einsteinium), yaitu isotop 253Es-nya, dapat dideteksi melalui peluruhan alfa berenergi tinggi yang khas pada 6,6 MeV.[5] Ia dihasilkan oleh penangkapan 15 neutron oleh inti uranium-238 diikuti oleh tujuh peluruhan beta, dan memiliki waktu paruh 20,5 hari. Penyerapan neutron ganda seperti itu dimungkinkan oleh kerapatan fluks neutron yang tinggi selama detonasi, sehingga isotop berat yang baru dihasilkan memiliki banyak neutron yang tersedia untuk diserap sebelum mereka dapat hancur menjadi unsur-unsur yang lebih ringan. Penangkapan neutron awalnya menaikkan nomor massa tanpa mengubah nomor atom nuklida, dan peluruhan beta secara bersamaan menghasilkan peningkatan nomor atom secara bertahap:[5]
Beberapa atom 238U, bagaimanapun, dapat menyerap dua neutron tambahan (dengan total 17), menghasilkan 255Es, serta isotop 255Fm dari unsur baru lainnya, fermium.[8] Penemuan unsur-unsur baru dan data baru terkait pada penangkapan neutron ganda pada awalnya dirahasiakan atas perintah militer A.S. sampai tahun 1955 karena ketegangan Perang Dingin dan persaingan dengan Uni Soviet dalam teknologi nuklir.[5][9][10] Namun, penangkapan cepat dari begitu banyak neutron akan memberikan konfirmasi eksperimental langsung dari apa yang disebut proses r penyerapan beberapa neutron yang diperlukan untuk menjelaskan nukleosintesis kosmik (produksi) unsur kimia berat tertentu (lebih berat dari nikel) dalam ledakan supernova, sebelum peluruhan beta. Proses seperti itu diperlukan untuk menjelaskan keberadaan banyak unsur stabil di alam semesta.[11]
Sementara itu, isotop unsur 99 (serta unsur baru 100, fermium) diproduksi di laboratorium Berkeley dan Argonee, dalam reaksi nuklir antara nitrogen-14 dan uranium-238,[12] dan kemudian dengan penyinaran intensif plutonium atau kalifornium dengan neutron:
Hasil-hasil ini diterbitkan dalam beberapa artikel pada tahun 1954 dengan penafian bahwa ini bukanlah studi pertama yang dilakukan pada unsur ini.[13][14][15][16][17] Tim Berkeley juga melaporkan beberapa hasil pada sifat kimia einsteinium dan fermium.[18][19] Hasil dari Ivy Mike dideklasifikasi dan diterbitkan pada tahun 1955.[9]
Dalam penemuan unsur 99 dan 100-nya, tim Amerika telah berkompetisi dengan kelompok di Institut Nobel untuk Fisika, Stockholm, Swedia. Pada akhir 1953 – awal 1954, kelompok Swedia berhasil menyintesis isotop ringan unsur 100, khususnya 250Fm, dengan membombardir uranium dengan inti oksigen. Hasil ini juga dipublikasikan pada tahun 1954.[20] Namun demikian, prioritas tim Berkeley secara umum diakui, karena publikasinya mendahului artikel Swedia, dan mereka didasarkan pada hasil ledakan termonuklir 1952 yang sebelumnya tidak diungkapkan; dengan demikian tim Berkeley diberi hak istimewa untuk menamai kedua unsur baru ini. Karena upaya yang mengarah pada desain Ivy Mike diberi nama kode Proyek PANDA,[21] unsur 99 secara bercanda dijuluki "Pandemonium"[22] tetapi nama resmi yang disarankan oleh kelompok Berkeley berasal dari dua ilmuwan terkemuka, Albert Einstein dan Enrico Fermi: "Kami menyarankan nama untuk unsur dengan nomor atom 99, einsteinium (lambang E) dari Albert Einstein dan untuk nama unsur dengan nomor atom 100, fermium (lambang Fm), dari Enrico Fermi."[9] Baik Einstein ataupun Fermi meninggal antara saat nama-nama itu awalnya diusulkan dan saat diumumkan. Penemuan unsur-unsur baru ini diumumkan oleh Albert Ghiorso pada Konferensi Atom Jenewa pertama yang diadakan pada tanggal 8–20 Agustus 1955.[5] Lambang untuk einsteinium pertama kali diberikan sebagai "E" dan kemudian diubah menjadi "Es" oleh IUPAC.[23][24]
Karakteristik
suntingFisik
suntingEinsteinium adalah logam sintetis, keperakan, dan radioaktif. Dalam tabel periodik, ia terletak di sebelah kanan aktinida kalifornium, di sebelah kiri aktinida fermium, dan di bawah lantanida holmium yang memiliki banyak kesamaan dalam sifat fisik dan kimia. Massa jenisnya yang sebesar 8,84 g/cm3 lebih rendah dari kalifornium (15,1 g/cm3) dan hampir sama dengan holmium (8,79 g/cm3), meskipun atom einsteinium jauh lebih berat daripada holmium. Titik lebur einsteinium (860 °C) juga relatif rendah – di bawah kalifornium (900 °C), fermium (1527 °C), dan holmium (1461 °C).[4][26] Einsteinium adalah logam yang lunak, dengan modulus kompresi hanya 15 GPa, yang nilainya merupakan salah satu yang terendah di antara logam nonalkali.[27]
Berlawanan dengan aktinida kalifornium, berkelium, kurium, dan amerisium yang lebih ringan, yang mengkristal dalam struktur heksagonal ganda pada kondisi sekitar, einsteinium diyakini memiliki simetri kubik berpusat muka (face-centered cubic, fcc) dengan grup ruang Fm3m dan konstanta kisi a = 575 pm. Namun, ada laporan mengenai logam einsteinium heksagonal suhu kamar dengan a = 398 pm dan c = 650 pm, yang diubah menjadi fase fcc pada pemanasan hingga suhu 300 °C.[28]
Kerusakan diri yang disebabkan oleh radioaktivitas einsteinium begitu kuat sehingga dengan cepat menghancurkan kisi kristalnya,[29] dan pelepasan energi selama proses ini, 1000 watt per gram 253Es, menginduksi cahaya yang terlihat.[3] Proses ini dapat berkontribusi pada massa jenis dan titik lebur yang relatif rendah dari einsteinium.[30] Selanjutnya, karena ukuran yang kecil dari sampel yang tersedia, titik lebur einsteinium sering disimpulkan dengan mengamati sampel yang dipanaskan di dalam mikroskop elektron.[31] Dengan demikian, efek permukaan dalam sampel kecil dapat mengurangi nilai titik lebur.
Logam ini trivalen dan memiliki volatilitas yang sangat tinggi.[32] Untuk mengurangi kerusakan radiasi sendiri, sebagian besar pengukuran einsteinium padat dan senyawanya dilakukan tepat setelah penganilan termal.[33] Juga, beberapa senyawa dipelajari di bawah atmosfer gas reduktor, misalnya H2O+HCl untuk EsOCl sehingga sampel sebagian tumbuh kembali selama dekomposisi.[34]
Terlepas dari penghancuran diri einsteinium padat dan senyawanya, kesulitan intrinsik lainnya dalam mempelajari unsur ini termasuk kelangkaan – isotop 253Es yang paling umum tersedia hanya sekali atau dua kali setahun dalam jumlah sub-miligram – dan kontaminasi sendiri karena konversi yang cepat dari einsteinium ke berkelium dan kemudian ke kalifornium dengan kecepatan sekitar 3,3% per hari:[35][36][37]
Dengan demikian, sebagian besar sampel einsteinium terkontaminasi, dan sifat intrinsiknya sering disimpulkan dengan mengekstrapolasi kembali data eksperimen yang terakumulasi dari waktu ke waktu. Teknik eksperimental lainnya untuk menghindari masalah kontaminasi termasuk eksitasi optik selektif ion einsteinium oleh laser yang dapat diatur, seperti dalam mempelajari sifat pendarannya.[38]
Sifat magnetik telah dipelajari untuk logam einsteinium, oksida dan fluoridanya. Ketiga bahan menunjukkan perilaku paramagnetik Curie–Weiss dari helium cair hingga suhu kamar. Momen magnetik efektif disimpulkan sebagai, 10,4±0,3 μB for Es2O3 dan 11,4±0,3 μB untuk EsF3, yang merupakan nilai tertinggi di antara aktinida, dan suhu Curie yang sesuai adalah 37 K.[39][40]
Kimia
suntingSeperti semua aktinida, einsteinium agak reaktif. Bilangan oksidasi trivalennya paling stabil dalam padatan dan larutan berair di mana ia menginduksi warna merah muda pucat.[41] Keberadaan einsteinium divalen sudah mapan, terutama dalam fase padat; keadaan +2 seperti ini tidak teramati di banyak aktinida lain, termasuk protaktinium, uranium, neptunium, plutonium, kurium, dan berkelium. Senyawa einsteinium(II) dapat diperoleh, misalnya, dengan mereduksi einsteinium(III) dengan samarium(II) klorida.[42] Bilangan oksidasi +4 telah dipostulasikan dari studi uap dan masih belum pasti.[43]
Isotop
suntingSembilan belas isotop dan tiga isomer nuklir diketahui untuk einsteinium, dengan nomor massa berkisar antara 240 hingga 257. Semuanya bersifat radioaktif dan nuklida paling stabil, 252Es, memiliki waktu paruh 471,7 hari.[44] Isotop paling stabil berikutnya adalah 254Es (waktu paruh 275,7 hari),[45] 255Es (39,8 hari), dan 253Es (20,47 hari). Semua isotop yang tersisa memiliki waktu paruh lebih pendek dari 40 jam, kebanyakan lebih pendek dari 30 menit. Dari tiga isomer nuklir, yang paling stabil adalah 254mEs dengan waktu paruh 39,3 jam.[46]
Fisi nuklir
suntingEinsteinium memiliki tingkat fisi nuklir yang tinggi yang menghasilkan massa kritis yang rendah untuk reaksi berantai nuklir yang berkelanjutan. Massa ini adalah 9,89 kilogram untuk bola telanjang isotop 254Es, dan dapat diturunkan menjadi 2,9 kilogram dengan menambahkan reflektor neutron baja setebal 30 sentimeter, atau bahkan menjadi 2,26 kilogram dengan reflektor air setebal 20 cm. Namun, bahkan massa kritis kecil ini jauh melebihi jumlah total einsteinium yang diisolasi sejauh ini, terutama isotop 254Es yang langka.[47]
Keterjadian alami
suntingKarena waktu paruh yang pendek dari semua isotop einsteinium, setiap einsteinium primordial—yaitu, einsteinium yang mungkin ada di Bumi selama pembentukan Bumi—telah lama meluruh. Penyintesisan einsteinium dari aktinida uranium dan torium yang terjadi secara alami di kerak Bumi membutuhkan penangkapan neutron ganda, yang merupakan peristiwa yang sangat tidak mungkin. Oleh karena itu, semua einsteinium terestrial diproduksi di laboratorium ilmiah, reaktor nuklir berdaya tinggi, atau dalam uji coba senjata nuklir, dan hadir hanya dalam beberapa tahun sejak waktu penyintesisan.[7]
Unsur-unsur transuranium dari amerisium hingga fermium, termasuk einsteinium, terjadi secara alami dalam reaktor fisi nuklir alami di Oklo, tetapi tidak lagi terjadi.[48]
Einsteinium secara teoretis teramati dalam spektrum Bintang Przybylski.[49] Namun, penulis utama studi yang menemukan einsteinium dan aktinida berumur pendek lainnya di Bintang Przybylski, Vera F. Gopka, secara langsung mengakui bahwa "posisi garis unsur radioaktif yang dicari hanya divisualisasikan dalam spektrum sintetis sebagai penanda vertikal karena tidak adanya data atom untuk garis-garis ini kecuali panjang gelombangnya (Sansonetti dkk. 2004), memungkinkan seseorang untuk menghitung profil mereka dengan intensitas yang kurang lebih nyata."[50] Spektrum jejak dari isotop einsteinium telah dianalisis secara komprehensif secara eksperimental (pada tahun 2021),[51] meskipun saat ini tidak ada penelitian yang diterbitkan untuk mengonfirmasi apakah jejak einsteinium yang diteorikan yang diusulkan untuk ditemukan dalam spektrum Bintang Przybylski cocok dengan hasil yang ditentukan laboratorium.
Sintesis dan ekstraksi
suntingEinsteinium diproduksi dalam jumlah kecil dengan membombardir aktinida yang lebih ringan dengan neutron dalam reaktor nuklir berfluks tinggi khusus. Sumber iradiasi utama dunia adalah Reaktor Isotop Fluks Tinggi (HFIR) 85 megawatt di Laboratorium Nasional Oak Ridge di Tennessee, A.S.,[53] dan reaktor loop SM-2 di Institut Riset Reaktor Atom (NIIAR) di Dimitrovgrad, Rusia,[54] yang keduanya didedikasikan untuk produksi unsur transkurium (Z > 96). Fasilitas ini memiliki kekuatan dan tingkat fluks yang sama, dan diperkirakan memiliki kapasitas produksi yang sebanding untuk unsur transkurium,[55] meskipun jumlah yang diproduksi di NIIAR tidak dilaporkan secara luas. Dalam "kampanye pemrosesan tipikal" di Oak Ridge, puluhan gram kurium disinari untuk menghasilkan jumlah desigram kalifornium, jumlah miligram berkelium (249Bk) dan einsteinium, serta jumlah pikogram fermium.[56][57]
Sampel mikroskopis pertama dari sampel 253Es dengan berat sekitar 10 nanogram disiapkan pada tahun 1961 di HFIR. Sebuah keseimbangan magnetik khusus dirancang untuk memperkirakan beratnya.[4][58] Batch yang lebih besar diproduksi kemudian mulai dari beberapa kilogram plutonium dengan hasil einsteinium (kebanyakan 253Es) 0,48 miligram pada tahun 1967–1970, 3,2 miligram pada tahun 1971–1973, diikuti oleh produksi stabil sekitar 3 miligram per tahun antara 1974 dan 1978.[59] Namun, jumlah ini mengacu pada jumlah integral dalam target tepat setelah iradiasi. Prosedur pemisahan selanjutnya mengurangi jumlah einsteinium murni secara isotop kira-kira sepuluh kali lipat.[55]
Sintesis laboratorium
suntingPenyinaran neutron berat plutonium menghasilkan empat isotop utama einsteinium: 253Es (pemancar α dengan waktu paruh 20,47 hari dan dengan waktu paruh fisi spontan 7×105 tahun); 254mEs (pemancar β dengan waktu paruh 39,3 jam), 254Es (pemancar α dengan waktu paruh sekitar 276 hari) dan 255Es (pemancar β dengan waktu paruh 39,8 hari).[60][46] Rute alternatif melibatkan pemborbardiran uranium-238 dengan nitrogen berintensitas tinggi atau sinar ion oksigen.[61]
Einsteinium-247 (waktu paruh 4,55 menit) diproduksi dengan menyinari amerisium-241 dengan karbon atau uranium-238 dengan ion nitrogen.[62] Reaksi terakhir pertama kali diwujudkan pada tahun 1967 di Dubna, Rusia, dan para ilmuwan yang terlibat dianugerahi Penghargaan Komsomol Lenin.[63]
Isotop 248Es diproduksi dengan menyinari 249Cf dengan ion deuterium. Ia meluruh terutama melalui emisi elektron menjadi 248Cf dengan waktu paruh 25±5 menit, tetapi juga melepaskan partikel energi 6,87 MeV, dengan rasio elektron terhadap partikel α sekitar 400.[64]
Isotop-isotop yang lebih berat, 249Es, 250Es, 251Es, dan 252Es, diperoleh dengan membombardir 249Bk dengan partikel α. Satu hingga empat neutron dibebaskan dalam proses ini yang memungkinkan pembentukan empat isotop berbeda dalam satu reaksi.[65]
Einsteinium-253 diproduksi dengan menyinari target 252Cf 0,1–0,2 miligram dengan fluks neutron termal (2–5)×1014 neutron·cm−2·s−1 selama 500–900 jam:[66]
Pada tahun 2020, para ilmuwan di Laboratorium Nasional Oak Ridge mampu membuat 233 nanogram 254Es, sebuah rekor dunia baru. Ini memungkinkan beberapa sifat kimia einsteinium untuk dipelajari untuk pertama kalinya.[67]
Sintesis dalam ledakan nuklir
suntingAnalisis puing-puing pada uji coba nuklir 10 megaton Ivy Mike adalah bagian dari proyek jangka panjang. Salah satu tujuannya adalah mempelajari efisiensi produksi unsur transuranium dalam ledakan nuklir berdaya tinggi. Motivasi untuk percobaan ini adalah bahwa penyintesisan unsur-unsur tersebut dari uranium membutuhkan penangkapan neutron ganda. Probabilitas peristiwa tersebut meningkat dengan fluks neutron, dan ledakan nuklir adalah sumber neutron buatan manusia yang paling kuat, memberikan massa jenis pada urutan 1023 neutron/cm2 dalam mikrodetik, atau sekitar 1029 neutron/(cm2·s). Sebagai perbandingan, fluks reaktor HFIR adalah 5×1015 neutron/(cm2·s). Sebuah laboratorium khusus didirikan tepat di Atol Enewetak untuk analisis awal puing, karena beberapa isotop dapat meluruh pada saat sampel puing mencapai daratan A.S. Laboratorium tersebut menerima sampel untuk analisis sesegera mungkin, dari pesawat yang dilengkapi dengan filter kertas yang terbang di atas atol setelah uji coba. Meskipun diharapkan untuk menemukan unsur-unsur kimia baru yang lebih berat dari fermium, tidak satupun dari unsur-unsur ini ditemukan bahkan setelah serangkaian ledakan megaton yang dilakukan antara tahun 1954 dan 1956 di atol tersebut.[6]
Hasil atmosfer dilengkapi dengan data uji bawah tanah yang terakumulasi pada 1960-an di Situs Uji Nevada, karena diharapkan ledakan kuat yang dilakukan di ruang terbatas dapat menghasilkan hasil yang lebih baik dan isotop yang lebih berat. Terlepas dari muatan uranium tradisional, kombinasi uranium dengan amerisium dan torium telah dicoba, serta muatan campuran plutonium-neptunium, tetapi mereka kurang berhasil dalam hal hasil dan dikaitkan dengan hilangnya isotop berat yang lebih kuat karena peningkatan laju fisi dalam muatan unsur berat. Isolasi produk bermasalah karena ledakan menyebarkan puing-puing melalui pencairan dan penguapan batuan di sekitarnya pada kedalaman 300–meter. Pengeboran ke kedalaman seperti itu untuk mengekstrak produk dinilai lambat dan tidak efisien dalam hal volume yang dikumpulkan.[6][68]
Di antara sembilan uji bawah tanah yang dilakukan antara tahun 1962 dan 1969,[69][70] uji coba terakhir adalah yang paling kuat dan memiliki hasil unsur transuranium tertinggi. Jumlah miligram einsteinium yang biasanya membutuhkan satu tahun penyinaran dalam reaktor daya tinggi, diproduksi dalam mikrodetik.[68] Namun, masalah praktis utama dari seluruh proposal adalah mengumpulkan puing-puing radioaktif yang tersebar oleh ledakan kuat. Filter pesawat hanya menyerap sekitar 4×10−14 dari jumlah total, dan pengumpulan berton-ton karang di Atol Enewetak meningkatkan fraksi ini hanya dua kali lipat. Ekstraksi sekitar 500 kilogram batuan bawah tanah 60 hari setelah ledakan Hutch hanya dipulihkan sekitar 1×10−7 dari total muatan. Jumlah unsur transuranium dalam tumpukan 500 kg ini hanya 30 kali lebih tinggi daripada dalam batuan 0,4 kg yang diambil 7 hari setelah pengujian yang menunjukkan ketergantungan yang sangat nonlinier dari hasil elemen transuranium pada jumlah batuan radioaktif yang diambil.[71] Poros dibor di lokasi tersebut sebelum pengujian untuk mempercepat pengumpulan sampel setelah ledakan, sehingga ledakan akan mengeluarkan bahan radioaktif dari pusat gempa melalui poros dan untuk mengumpulkan volume di dekat permukaan. Metode ini dicoba dalam dua kali pengujian dan langsung memberikan ratusan kilogram material, tetapi dengan konsentrasi aktinida 3 kali lebih rendah daripada sampel yang diperoleh setelah pengeboran. Sedangkan metode tersebut dapat menjadi efisien dalam studi ilmiah isotop berumur pendek, ia tidak dapat meningkatkan efisiensi pengumpulan keseluruhan aktinida yang dihasilkan.[72]
Meskipun tidak ada unsur baru (selain einsteinium dan fermium) yang dapat dideteksi dalam puing-puing uji coba nuklir, dan hasil total unsur transuranium sangat rendah, pengujian ini memberikan jumlah isotop berat langka yang jauh lebih tinggi daripada yang sebelumnya tersedia di laboratorium.[73]
Pemisahan
suntingProsedur pemisahan einsteinium bergantung pada metode penyintesisan. Dalam kasus pemborbardiran ion ringan di dalam siklotron, target ion berat melekat pada foil tipis, dan einsteinium yang dihasilkan hanya dicuci dari foil setelah penyinaran. Namun, jumlah yang dihasilkan dalam eksperimen semacam itu relatif rendah.[74] Hasilnya jauh lebih tinggi untuk penyinaran reaktor, tetapi di sana, produknya adalah campuran dari berbagai isotop aktinida, serta lantanida yang dihasilkan dalam peluruhan fisi nuklir. Dalam hal ini, isolasi einsteinium adalah prosedur yang membosankan yang melibatkan beberapa langkah pertukaran kation berulang, pada suhu dan tekanan tinggi, serta kromatografi. Pemisahan dari berkelium adalah prosedur penting, karena isotop einsteinium yang paling umum diproduksi di reaktor nuklir, 253Es, meluruh dengan waktu paruh hanya 20 hari menjadi 249Bk, yang cepat pada skala waktu kebanyakan eksperimen. Pemisahan tersebut bergantung pada fakta bahwa berkelium mudah teroksidasi menjadi keadaan +4 padat dan mengendap, sedangkan aktinida lain, termasuk einsteinium, tetap dalam keadaan +3 dalam larutan.[75]
Pemisahan aktinida trivalen dari produk fisi lantanida dapat dilakukan dengan kolom resin penukar kation menggunakan larutan 90% air/10% etanol jenuh dengan asam klorida (HCl) sebagai eluan. Ia biasanya dilanjutkan dengan kromatografi pertukaran anion menggunakan 6 molar HCl sebagai eluan. Kolom resin penukar kation (kolom penukar Dowex-50) yang diolah dengan garam amonium kemudian digunakan untuk memisahkan fraksi yang mengandung unsur 99, 100 dan 101. Unsur-unsur ini kemudian dapat diidentifikasi hanya berdasarkan posisi/waktu elusinya, menggunakan larutan α-hidroksiisobutirat (α-HIB), misalnya, sebagai eluan.[76]
Pemisahan aktinida 3+ juga dapat dicapai dengan kromatografi ekstraksi pelarut, menggunakan asam fosfat bis-(2-etilheksil) (disingkat HDEHP) sebagai fase organik stasioner, dan asam nitrat sebagai fase berair bergerak. Urutan elusi aktinida dibalik dari kolom resin penukar kation. Pemisahan einsteinium dengan metode ini memiliki keuntungan bebas dari zat pengompleks organik, dibandingkan dengan pemisahan menggunakan kolom resin.[76]
Persiapan
suntingEinsteinium sangatlah reaktif dan oleh karena itu diperlukan zat pereduksi yang kuat untuk mendapatkan einsteinium murni dari senyawanya.[77] Ini dapat dicapai dengan mereduksi einsteinium(III) fluorida dengan litium metalik:
- EsF3 + 3 Li → Es + 3 LiF
Namun, karena titik leburnya yang rendah dan tingkat kerusakan radiasi sendiri yang tinggi, einsteinium memiliki tekanan uap yang tinggi, yang lebih tinggi daripada litium fluorida. Hal ini membuat reaksi reduksi ini agak tidak efisien. Reaksi ini dicoba dalam upaya persiapan awal dan dengan cepat ditinggalkan demi reduksi einsteinium(III) oksida dengan logam lantanum:[28][30][78]
- Es2O3 + 2 La → 2 Es + La2O3
Senyawa kimia
sunting| Senyawa | Warna | Simetri | Grup ruang | No | Simbol Pearson | a (pm) | b (pm) | c (pm) |
|---|---|---|---|---|---|---|---|---|
| Es2O3 | Tanpa warna | Kubik[36] | Ia3 | 206 | cI80 | 1076,6 | ||
| Es2O3 | Tanpa warna | Monoklinik[79] | C2/m | 12 | mS30 | 1411 | 359 | 880 |
| Es2O3 | Tanpa warna | Heksagonal[79] | P3m1 | 164 | hP5 | 370 | 600 | |
| EsF3 | Heksagonal[35] | |||||||
| EsF4 | Monoklinik[80] | C2/c | 15 | mS60 | ||||
| EsCl3 | Jingga | Heksagonal[81][82] | C63/m | hP8 | 727 | 410 | ||
| EsBr3 | Kuning | Monoklinik[83] | C2/m | 12 | mS16 | 727 | 1259 | 681 |
| EsI3 | Ambar | Heksagonal[84][85] | R3 | 148 | hR24 | 753 | 2084 | |
| EsOCl | Tetragonal[84][86] | P4/nmm | 394,8 | 670,2 |
Oksida
suntingEinsteinium(III) oksida (Es2O3) diperoleh dengan membakar einsteinium(III) nitrat. Ia membentuk kristal kubik tanpa warna, yang pertama kali dicirikan dari sampel mikrogram berukuran sekitar 30 nanometer.[29][36] Dua fase lain, monoklinik dikenal untuk oksida ini. Pembentukan fase Es2O3 tertentu bergantung pada teknik persiapan serta riwayat sampel, dan tidak ada diagram fase yang jelas. Interkonversi antara ketiga fase dapat terjadi secara spontan, sebagai akibat dari penyinaran sendiri atau pemanasan sendiri.[87] Fase heksagonal isotipik dengan lantanum oksida di mana ion Es3+ dikelilingi oleh 6 kelompok ion O2− yang terkoordinasi.[79][84]
Halida
suntingEinsteinium halida dikenal dengan bilangan oksidasi +2 dan +3.[86][88] Keadaan paling stabil adalah +3 untuk semua halida dari fluorida sampai iodida.
Einsteinium(III) fluorida (EsF3) dapat diendapkan dari larutan einsteinium(III) klorida pada reaksi dengan ion fluorida. Prosedur persiapan alternatif adalah dengan memaparkan einsteinium(III) oksida ke klorin trifluorida (ClF3) atau gas F2 pada tekanan 1–2 atmosfer dan suhu antara 300 dan 400 °C. Struktur kristal EsF3 adalah heksagonal, seperti pada kalifornium(III) fluorida (CfF3) di mana ion Es3+ dikoordinasikan oleh ion fluorin 8 kali lipat dalam susunan prisma trigonal tertutup ganda.[35][89][90]
Einsteinium(III) klorida (EsCl3) dapat dibuat dengan menganil einsteinium(III) oksida dalam atmosfer uap hidrogen klorida kering pada suhu sekitar 500 °C selama sekitar 20 menit. Ia mengkristal pada pendinginan sekitar 425 °C menjadi padatan jingga dengan struktur heksagonal tipe UCl3, di mana atom einsteinium dikoordinasikan oleh atom klorin 9 kali lipat dalam geometri prisma trigonal tertutup lipat tiga.[82][89][91] Einsteinium(III) bromida (EsBr3) adalah padatan kuning pucat dengan struktur monoklinik tipe AlCl3, di mana atom einsteinium dikoordinasikan secara oktahedral oleh bromin (bilangan koordinasi 6).[85][89]
Senyawa divalen einsteinium diperoleh dengan mereduksi halida trivalen dengan hidrogen:[92]
- 2 EsX3 + H2 → 2 EsX2 + 2 HX, X = F, Cl, Br, I
Einsteinium(II) klorida (EsCl2),[93] einsteinium(II) bromida (EsBr2),[94] dan einsteinium(II) iodida (EsI2)[86] telah diproduksi dan dikarakterisasi dengan penyerapan optis, tanpa informasi struktural yang belum tersedia.[85]
Oksihalida einsteinium yang dikenal termasuk EsOCl,[86] EsOBr,[92] dan EsOI.[86] Garam-garam ini disintesis dengan memperlakukan trihalida dengan campuran uap air dan hidrogen halida yang sesuai: misalnya, EsCl3 + H2O/HCl untuk mendapatkan EsOCl.[34]
Senyawa organoeinsteinium
suntingRadioaktivitas einsteinium yang tinggi memiliki potensi penggunaan dalam terapi radiasi, dan kompleks organologam telah disintesis untuk mengirimkan atom einsteinium ke organ yang sesuai di dalam tubuh. Eksperimen telah dilakukan dengan menyuntikkan einsteinium sitrat (serta senyawa fermium) pada anjing.[3] Einsteinium(III) juga dimasukkan ke dalam kompleks kelat diketon beta, karena kompleks analog dengan lantanida sebelumnya menunjukkan pendaran tereksitasi UV terkuat di antara senyawa metalorganik. Saat menyiapkan kompleks einsteinium, ion Es3+ diencerkan 1000 kali dengan ion Gd3+. Hal ini memungkinkan pengurangan kerusakan radiasi sehingga senyawa tidak hancur selama periode 20 menit yang diperlukan untuk pengukuran. Pendaran yang dihasilkan dari Es3+ terlalu lemah untuk dideteksi. Hal ini dijelaskan oleh energi relatif yang tidak menguntungkan dari masing-masing konstituen senyawa yang menghambat transfer energi yang efisien dari matriks kelat ke ion Es3+. Kesimpulan serupa ditarik untuk aktinida lain, seperti amerisium, berkelium, dan fermium.[95]
Namun, pendaran ion Es3+ teramati dalam larutan asam klorida anorganik serta dalam larutan organik dengan asam di(2-etilheksil)ortofosfat. Ia menunjukkan puncak yang luas pada sekitar 1064 nanometer (lebar setengah sekitar 100 nm) yang dapat dieksitasi secara resonansi oleh cahaya hijau (panjang gelombang sekitar 495 nm). Pendaran tersebut memiliki masa hidup beberapa mikrodetik dan hasil kuantum di bawah 0,1%. Tingkat peluruhan nonradiatif yang relatif tinggi, dibandingkan dengan lantanida pada Es3+ dikaitkan dengan interaksi elektron-f yang lebih kuat dengan elektron Es3+ bagian dalam.[96]
Aplikasi
suntingIsotop einsteinium hampir tidak memiliki kegunaan di luar penelitian ilmiah dasar yang bertujuan untuk produksi unsur transuranium dan unsur superberat yang lebih tinggi.[97]
Pada tahun 1955, mendelevium disintesis dengan menyinari target yang terdiri dari sekitar 109 atom 253Es dalam siklotron 60 inci di Laboratorium Berkeley. Reaksi 253Es(α,n)256Md yang dihasilkan menghasilkan 17 atom unsur baru dengan nomor atom 101.[98]
Isotop langka 254Es disukai untuk produksi unsur superberat karena massanya yang besar, waktu paruh yang relatif lama yaitu 270 hari, dan ketersediaannya dalam jumlah yang signifikan (beberapa mikrogram).[99] Oleh karena itu, 254Es digunakan sebagai target dalam percobaan penyintesisan ununenium (unsur 119) pada tahun 1985 dengan membombardirnya dengan ion kalsium-48 pada pemercepat partikel linier superHILAC di Berkeley, California. Tidak ada atom yang teridentifikasi, menetapkan batas atas untuk penampang reaksi ini pada 300 nanobarn.[100]
254Es digunakan sebagai penanda kalibrasi dalam spektrometer analisis kimia ("penganalisis permukaan hamburan alfa") dari prob bulan Surveyor 5. Massa besar dari isotop ini mengurangi tumpang tindih spektral antara sinyal dari penanda dan unsur yang lebih ringan yang dipelajari dari permukaan bulan.[101]
Keamanan
suntingSebagian besar data toksisitas einsteinium yang tersedia, berasal dari penelitian pada hewan. Setelah tertelan oleh tikus, hanya ~0,01% yang berakhir di aliran darah. Dari sana, sekitar 65% pergi ke tulang, di mana ia akan tinggal selama ~50 tahun jika bukan karena peluruhan radioaktifnya, belum lagi umur maksimum tikus 3 tahun, 25% ke paru-paru (waktu paruh biologis ~20 tahun, meskipun ini lagi-lagi dianggap tidak relevan dengan waktu paruh einsteinium yang pendek), 0,035% pada testis atau 0,01% pada ovarium – di mana einsteinium menetap tanpa batas. Sekitar 10% dari jumlah yang tertelan akan diekskresikan. Distribusi einsteinium di atas permukaan tulang seragam dan mirip dengan plutonium.[102]
Referensi
sunting- ^ (Indonesia) "Einsteinium". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Einsteinium Diarsipkan 19 Mei 2021 di Wayback Machine.. periodic.lanl.gov
- ^ a b c Haire, hlm. 1579
- ^ a b c Hammond C. R. "The elements" dalam Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ a b c d e f g Ghiorso, Albert (2003). "Einsteinium and Fermium". Chemical and Engineering News. 81 (36): 174–175. doi:10.1021/cen-v081n036.p174. Diarsipkan dari versi asli tanggal 6 September 2018. Diakses tanggal 26 September 2022.
- ^ a b c Seaborg, hlm. 39
- ^ a b John Emsley Nature's building blocks: an A-Z guide to the elements Diarsipkan 9 Juni 2016 di Wayback Machine., Oxford University Press, 2003, ISBN 0-19-850340-7 hlm. 133–135
- ^ 254Es, 254Fm, dan 253Fm tidak akan terproduksi karena kurangnya peluruhan beta pada 254Cf dan 253Es
- ^ a b c Ghiorso, A.; Thompson, S.; Higgins, G.; Seaborg, G.; Studier, M.; Fields, P.; Fried, S.; Diamond, H.; Mech, J.; Pyle, G.; Huizenga, J.; Hirsch, A.; Manning, W.; Browne, C.; Smith, H.; Spence, R. (1955). "New Elements Einsteinium and Fermium, Atomic Numbers 99 and 100". Phys. Rev. 99 (3): 1048–1049. Bibcode:1955PhRv...99.1048G. doi:10.1103/PhysRev.99.1048. Diarsipkan dari versi asli tanggal 19 Mei 2021. Diakses tanggal 26 September 2022. Google Books Diarsipkan 13 April 2016 di Wayback Machine.
- ^ Fields, P.; Studier, M.; Diamond, H.; Mech, J.; Inghram, M.; Pyle, G.; Stevens, C.; Fried, S.; Manning, W.; Pyle, G.; Huizenga, J.; Hirsch, A.; Manning, W.; Browne, C.; Smith, H.; Spence, R. (1956). "Transplutonium Elements in Thermonuclear Test Debris". Physical Review. 102 (1): 180–182. Bibcode:1956PhRv..102..180F. doi:10.1103/PhysRev.102.180. Google Books Diarsipkan 23 April 2016 di Wayback Machine.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, NY, 2011, ISBN 978-0-486-48238-5 (pbk.) hlm. 267.
- ^ Ghiorso, Albert; Rossi, G. Bernard; Harvey, Bernard G.; Thompson, Stanley G. (1954). "Reactions of U-238 with Cyclotron-Produced Nitrogen Ions". Physical Review. 93 (1): 257. Bibcode:1954PhRv...93..257G. doi:10.1103/PhysRev.93.257.
- ^ Thompson, S. G.; Ghiorso, A.; Harvey, B. G.; Choppin, G. R. (1954). "Transcurium Isotopes Produced in the Neutron Irradiation of Plutonium". Physical Review. 93 (4): 908. Bibcode:1954PhRv...93..908T. doi:10.1103/PhysRev.93.908. Diarsipkan dari versi asli tanggal 16 Maret 2020. Diakses tanggal 26 September 2022.
- ^ Harvey, Bernard; Thompson, Stanley; Ghiorso, Albert; Choppin, Gregory (1954). "Further Production of Transcurium Nuclides by Neutron Irradiation". Physical Review. 93 (5): 1129. Bibcode:1954PhRv...93.1129H. doi:10.1103/PhysRev.93.1129. Diarsipkan dari versi asli tanggal 9 Maret 2020. Diakses tanggal 26 September 2022.
- ^ Studier, M.; Fields, P.; Diamond, H.; Mech, J.; Friedman, A.; Sellers, P.; Pyle, G.; Stevens, C.; Magnusson, L.; Huizenga, J. (1954). "Elements 99 and 100 from Pile-Irradiated Plutonium". Physical Review. 93 (6): 1428. Bibcode:1954PhRv...93.1428S. doi:10.1103/PhysRev.93.1428.
- ^ Choppin, G. R.; Thompson, S. G.; Ghiorso, A.; Harvey, B. G. (1954). "Nuclear Properties of Some Isotopes of Californium, Elements 99 and 100". Physical Review. 94 (4): 1080–1081. Bibcode:1954PhRv...94.1080C. doi:10.1103/PhysRev.94.1080.
- ^ Fields, P.; Studier, M.; Mech, J.; Diamond, H.; Friedman, A.; Magnusson, L.; Huizenga, J. (1954). "Additional Properties of Isotopes of Elements 99 and 100". Physical Review. 94 (1): 209–210. Bibcode:1954PhRv...94..209F. doi:10.1103/PhysRev.94.209.
- ^ Seaborg, G. T.; Thompson, S.G.; Harvey, B.G. and Choppin, G.R. (23 Juli 1954) "Chemical Properties of Elements 99 and 100" Diarsipkan 10 Juli 2019 di Wayback Machine., Radiation Laboratory, Universitas California, Berkeley, UCRL-2591
- ^ Thompson, S. G.; Harvey, B. G.; Choppin, G. R.; Seaborg, G. T. (1954). "Chemical Properties of Elements 99 and 100". Journal of the American Chemical Society. 76 (24): 6229–6236. doi:10.1021/ja01653a004. Diarsipkan dari versi asli tanggal 20 Oktober 2019. Diakses tanggal 26 September 2022.
- ^ Atterling, Hugo; Forsling, Wilhelm; Holm, Lennart; Melander, Lars; Åström, Björn (1954). "Element 100 Produced by Means of Cyclotron-Accelerated Oxygen Ions". Physical Review. 95 (2): 585–586. Bibcode:1954PhRv...95..585A. doi:10.1103/PhysRev.95.585.2.
- ^ Richard Lee Miller (1991). Under the cloud: the decades of nuclear testing. Two-Sixty Press. hlm. 115. ISBN 978-1-881043-05-8.
- ^ McPhee, John (1980). The Curve of Binding Energy. Farrar, Straus & Giroux Inc. hlm. 116. ISBN 978-0-374-51598-0.
- ^ Haire, hlm. 1577
- ^ Seaborg, G.T. (1994) Modern alchemy: selected papers of Glenn T. Seaborg Diarsipkan 9 Juni 2016 di Wayback Machine., World Scientific, hlm. 6, ISBN 981-02-1440-5.
- ^ Haire, hlm. 1580
- ^ Haire, R. G. (1990) "Properties of the Transplutonium Metals (Am-Fm)", in: Metals Handbook, Vol. 2, edisi ke-10, (ASM International, Materials Park, Ohio), hlm. 1198–1201.
- ^ Haire, hlm. 1591
- ^ a b Haire, R. (1986). "Preparation, properties, and some recent studies of the actinide metals". Journal of the Less Common Metals. 121: 379–398. doi:10.1016/0022-5088(86)90554-0. Diarsipkan dari versi asli tanggal 13 Mei 2013. Diakses tanggal 27 September 2022.
- ^ a b Greenwood, hlm. 1268
- ^ a b Haire, R. G.; Baybarz, R. D. (1979). "Studies of einsteinium metal" (PDF). Le Journal de Physique. 40: C4–101. doi:10.1051/jphyscol:1979431. Diarsipkan dari versi asli (PDF) tanggal 7 Maret 2012. Diakses tanggal 26 September 2022. draft manuscript Diarsipkan 10 Juli 2019 di Wayback Machine.
- ^ Seaborg, hlm. 61
- ^ Kleinschmidt, Phillip D.; Ward, John W.; Matlack, George M.; Haire, Richard G. (1984). "Henry's Law vaporization studies and thermodynamics of einsteinium-253 metal dissolved in ytterbium". The Journal of Chemical Physics. 81 (1): 473–477. Bibcode:1984JChPh..81..473K. doi:10.1063/1.447328.
- ^ Seaborg, hlm. 52
- ^ a b Seaborg, hlm. 60
- ^ a b c Ensor, D. D.; Peterson, J. R.; Haire, R. G.; Young, J. P. (1981). "Absorption spectrophotometric study of 253EsF3 and its decay products in the bulk-phase solid state". Journal of Inorganic and Nuclear Chemistry. 43 (10): 2425–2427. doi:10.1016/0022-1902(81)80274-6.
- ^ a b c Haire, R. G.; Baybarz, R. D. (1973). "Identification and analysis of einsteinium sesquioxide by electron diffraction". Journal of Inorganic and Nuclear Chemistry. 35 (2): 489–496. doi:10.1016/0022-1902(73)80561-5.
- ^ Seaborg, hlm. 55
- ^ Seaborg, hlm. 76
- ^ Huray, P.; Nave, S.; Haire, R. (1983). "Magnetism of the heavy 5f elements". Journal of the Less Common Metals. 93 (2): 293–300. doi:10.1016/0022-5088(83)90175-3.
- ^ Huray, Paul G.; Nave, S. E.; Haire, R. G.; Moore, J. R. (1984). "Magnetic Properties of Es2O3 and EsF3". Inorganica Chimica Acta. 94 (1–3): 120–122. doi:10.1016/S0020-1693(00)94587-0.
- ^ Holleman, hlm. 1956
- ^ Seaborg, hlm. 53
- ^ Haire, hlm. 1578
- ^ Ahmad, I.; Wagner, Frank (1977). "Half-life of the longest-lived einsteinium isotope-252Es". Journal of Inorganic and Nuclear Chemistry. 39 (9): 1509–1511. doi:10.1016/0022-1902(77)80089-4.
- ^ McHarris, William; Stephens, F.; Asaro, F.; Perlman, I. (1966). "Decay Scheme of Einsteinium-254". Physical Review. 144 (3): 1031–1045. Bibcode:1966PhRv..144.1031M. doi:10.1103/PhysRev.144.1031.
- ^ a b Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- ^ Institut de Radioprotection et de Sûreté Nucléaire, "Evaluation of nuclear criticality safety data and limits for actinides in transport" Diarsipkan 6 Maret 2017l6 di Wayback Machine., hlm. 16.
- ^ Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (edisi ke-New). New York, NY: Oxford University Press. ISBN 978-0-19-960563-7.
- ^ Gopka, V. F.; Yushchenko, A. V.; Yushchenko, V. A.; Panov, I. V.; Kim, Ch. (2008). "Identification of absorption lines of short half-life actinides in the spectrum of Przybylski's star (HD 101065)". Kinematics and Physics of Celestial Bodies. 24 (2): 89–98. Bibcode:2008KPCB...24...89G. doi:10.3103/S0884591308020049.
- ^ Gopka, V. F.; Yushchenko, Alexander V.; Shavrina, Angelina V.; Mkrtichian, David E.; Hatzes, Artie P.; Andrievsky, Sergey M.; Chernysheva, Larissa V. (2005). "On the radioactive shells in peculiar main sequence stars: the phenomenon of Przybylski's star". Proceedings of the International Astronomical Union. 2004: 734–742. doi:10.1017/S174392130500966X.
- ^ Nothhelfer, S.; Albrecht-Schönzart, Th.E.; Block, M.; Chhetri, P.; Düllmann, Ch.E.; Ezold, J.G.; Gadelshin, V.; Gaiser, A.; Giacoppo, F.; Heinke, R.; Kieck, T.; Kneip, N.; Laatiaoui, M.; Mokry, Ch.; Raeder, S.; Runke, J.; Schneider, F.; Sperling, J.M.; Studer, D.; Thörle-Pospiech, P.; Trautmann, N.; Weber, F.; Wendt, K. (2022). "Nuclear structure investigations of 253−255Es by laser spectroscopy". Physical Review C. 105. doi:10.1103/PhysRevC.105.L021302.
- ^ Seaborg, hlm. 51
- ^ "High Flux Isotope Reactor". Laboratorium Nasional Oak Ridge. Diarsipkan dari versi asli tanggal 28 Februari 2015. Diakses tanggal 26 September 2022.
- ^ Радионуклидные источники и препараты (dalam bahasa Rusia). Research Institute of Atomic Reactors. Diarsipkan dari versi asli tanggal 26 Juli 2020. Diakses tanggal 26 September 2022.
- ^ a b Haire, hlm. 1582
- ^ Greenwood, hlm. 1262
- ^ Porter, C. E.; Riley, F. D., Jr.; Vandergrift, R. D.; Felker, L. K. (1997). "Fermium Purification Using Teva Resin Extraction Chromatography". Sep. Sci. Technol. 32 (1–4): 83–92. doi:10.1080/01496399708003188. Diarsipkan dari versi asli tanggal 11 Maret 2020. Diakses tanggal 26 September 2022.
- ^ Hoffman, Darleane C.; Ghiorso, Albert dan Seaborg, Glenn Theodore (2000) The Transuranium People: The Inside Story, Imperial College Press, hlm. 190–191, ISBN 978-1-86094-087-3.
- ^ Seaborg, hlm. 36–37
- ^ Jones, M.; Schuman, R.; Butler, J.; Cowper, G.; Eastwood, T.; Jackson, H. (1956). "Isotopes of Einsteinium and Fermium Produced by Neutron Irradiation of Plutonium". Physical Review. 102 (1): 203–207. Bibcode:1956PhRv..102..203J. doi:10.1103/PhysRev.102.203.
- ^ Guseva, L.; Filippova, K.; Gerlit, Y.; Druin, V.; Myasoedov, B.; Tarantin, N. (1956). "Experiments on the production of einsteinium and fermium with a cyclotron". Journal of Nuclear Energy. 3 (4): 341–346. doi:10.1016/0891-3919(56)90064-X.
- ^ Harry H. Binder: Lexikon der chemischen Elemente, S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3, hlm. 18–23.
- ^ Эйнштейний Diarsipkan 19 Mei 2021 di Wayback Machine. (dalam bahasa Rusia, sebuah artikel populer oleh salah satu ilmuwan yang terlibat)
- ^ Chetham-Strode, A.; Holm, L. (1956). "New Isotope Einsteinium-248". Physical Review. 104 (5): 1314. Bibcode:1956PhRv..104.1314C. doi:10.1103/PhysRev.104.1314.
- ^ Harvey, Bernard; Chetham-Strode, Alfred; Ghiorso, Albert; Choppin, Gregory; Thompson, Stanley (1956). "New Isotopes of Einsteinium". Physical Review. 104 (5): 1315–1319. Bibcode:1956PhRv..104.1315H. doi:10.1103/PhysRev.104.1315. Diarsipkan dari versi asli tanggal 12 Maret 2020. Diakses tanggal 26 September 2022.
- ^ Kulyukhin, S.; Auerman, L. N.; Novichenko, V. L.; Mikheev, N. B.; Rumer, I. A.; Kamenskaya, A. N.; Goncharov, L. A.; Smirnov, A. I. (1985). "Production of microgram quantities of einsteinium-253 by the reactor irradiation of californium". Inorganica Chimica Acta. 110: 25–26. doi:10.1016/S0020-1693(00)81347-X.
- ^ Carter, Korey P.; Shield, Katherine M.; Smith, Kurt F.; Jones, Zachary R.; Wacker, Jennifer N.; Arnedo-Sanchez, Leticia; Mattox, Tracy M.; Moreau, Liane M.; Knope, Karah E.; Kozimor, Stosh A.; Booth, Corwin H.; Abergel, Rebecca J. (3 Februari 2021). "Structural and spectroscopic characterization of an einsteinium complex". Nature. 590 (7844): 85–88. Bibcode:2021Natur.590...85C. doi:10.1038/s41586-020-03179-3. OSTI 1777970. PMID 33536647 Periksa nilai
|pmid=(bantuan). Diarsipkan dari versi asli tanggal 3 Februari 2021. Diakses tanggal 26 September 2022. - ^ a b c Seaborg, hlm. 40
- ^ Mereka diberi nama kode: "Anacostia" (5,2 kiloton, 1962), "Kennebec" (<5 kiloton, 1963), "Par" (38 kiloton, 1964), "Barbel" (<20 kiloton, 1964), "Tweed" (<20 kiloton, 1965), "Cyclamen" (13 kiloton, 1966), "Kankakee" (20-200 kiloton, 1966), "Vulcan" (25 kiloton, 1966) dan "Hutch" (20-200 kiloton, 1969)
- ^ United States Nuclear Tests Juli 1945 hingga September 1992 Diarsipkan 15 Juni 2010 di Wayback Machine., DOE/NV--209-REV 15, Desember 2000.
- ^ Seaborg, hlm. 43
- ^ Seaborg, hlm. 44
- ^ Seaborg, hlm. 47
- ^ Haire, hlm. 1583
- ^ Haire, hlm. 1584–1585
- ^ a b Hall, Nina (2000). The new chemistry. Cambridge University Press. hlm. 9–11. ISBN 978-0-521-45224-3. Diarsipkan dari versi asli tanggal 20 Juni 2016. Diakses tanggal 27 September 2022.
- ^ Haire, hlm. 1588
- ^ Haire, hlm. 1590
- ^ a b c Haire, R. G.; Eyring, L. (1994). "Lanthanides and Actinides Chemistry". Dalam K.A. Gscheidner, Jr.; et al. Handbook on the Physics and Chemistry of Rare Earths. 18. North-Holland, New York. hlm. 414–505. ISBN 978-0-444-81724-2.
- ^ Kleinschmidt, P. (1994). "Thermochemistry of the actinides". Journal of Alloys and Compounds. 213–214: 169–172. doi:10.1016/0925-8388(94)90898-2. Diarsipkan dari versi asli tanggal 16 Maret 2020. Diakses tanggal 27 September 2022.
- ^ Fujita, D.; Cunningham, B. B.; Parsons, T. C. (1969). "Crystal structures and lattice parameters of einsteinium trichloride and einsteinium oxychloride". Inorganic and Nuclear Chemistry Letters. 5 (4): 307–313. doi:10.1016/0020-1650(69)80203-5. Diarsipkan dari versi asli tanggal 13 Maret 2020. Diakses tanggal 27 September 2022.
- ^ a b Miasoedov, B. F. Analytical chemistry of transplutonium elements, Wiley, 1974 (Yang asli berasal dari Universitas California), ISBN 0-470-62715-8, hlm. 99
- ^ Fellows, R.; Peterson, J. R.; Noé, M.; Young, J. P.; Haire, R. G. (1975). "X-ray diffraction and spectroscopic studies of crystalline einsteinium(III) bromide, 253EsBr3". Inorganic and Nuclear Chemistry Letters. 11 (11): 737–742. doi:10.1016/0020-1650(75)80090-0.
- ^ a b c Haire, hlm. 1595–1596
- ^ a b c Seaborg, hlm. 62
- ^ a b c d e Young, J. P.; Haire, R. G.; Peterson, J. R.; Ensor, D. D.; Fellow, R. L. (1981). "Chemical consequences of radioactive decay. 2. Spectrophotometric study of the ingrowth of berkelium-249 and californium-249 into halides of einsteinium-253". Inorganic Chemistry. 20 (11): 3979–3983. doi:10.1021/ic50225a076.
- ^ Haire, hlm. 1598
- ^ Holleman, hlm. 1969
- ^ a b c Greenwood, hlm. 1270
- ^ Young, J. P.; Haire, R. G.; Fellows, R. L.; Peterson, J. R. (1978). "Spectrophotometric studies of transcurium element halides and oxyhalides in the solid state". Journal of Radioanalytical Chemistry. 43 (2): 479–488. doi:10.1007/BF02519508.
- ^ Fujita, D.; Cunningham, B. B.; Parsons, T. C.; Peterson, J. R. (1969). "The solution absorption spectrum of Es3+". Inorganic and Nuclear Chemistry Letters. 5 (4): 245–250. doi:10.1016/0020-1650(69)80192-3. Diarsipkan dari versi asli tanggal 9 Maret 2020. Diakses tanggal 27 September 2022.
- ^ a b Peterson, J.R.; et al. (1979). "Preparation, characterization, and decay of einsteinium(II) in the solid state" (PDF). Le Journal de Physique. 40 (4): C4–111. CiteSeerX 10.1.1.729.8671 . doi:10.1051/jphyscol:1979435. Diarsipkan dari versi asli (PDF) tanggal 7 Maret 2012. Diakses tanggal 27 September 2022. manuscript draft Diarsipkan 13 Mei 2013 di Wayback Machine.
- ^ Fellows, R.L.; Young, J.P.; Haire, R.G. dan Peterson J.R. (1977) dalam: GJ McCarthy and JJ Rhyne (eds) The Rare Earths in Modern Science and Technology, Plenum Press, New York, hlm. 493–499.
- ^ Young, J.P.; Haire R.G., Fellows, R.L.; Noe, M. dan Peterson, J.R. (1976) "Spectroscopic and X-Ray Diffraction Studies of the Bromides of Californium-249 and Einsteinium-253", dalam: W. Müller and R. Lindner (eds.) Plutonium 1975, North Holland, Amsterdam, hlm. 227–234.
- ^ Nugent, Leonard J.; Burnett, J. L.; Baybarz, R. D.; Werner, George Knoll; Tanner, S. P.; Tarrant, J. R.; Keller, O. L. (1969). "Intramolecular energy transfer and sensitized luminescence in actinide(III) .beta.-diketone chelates". The Journal of Physical Chemistry. 73 (5): 1540–1549. doi:10.1021/j100725a060.
- ^ Beitz, J.; Wester, D.; Williams, C. (1983). "5f state interaction with inner coordination sphere ligands: Es3+ ion fluorescence in aqueous and organic phases". Journal of the Less Common Metals. 93 (2): 331–338. doi:10.1016/0022-5088(83)90178-9.
- ^ It's Elemental – The Element Einsteinium Diarsipkan 10 Juli 2019 di Wayback Machine.. Diakses tanggal 27 September 2022.
- ^ Ghiorso, A.; Harvey, B.; Choppin, G.; Thompson, S.; Seaborg, G. (1955). "New Element Mendelevium, Atomic Number 101". Physical Review. 98 (5): 1518–1519. Bibcode:1955PhRv...98.1518G. doi:10.1103/PhysRev.98.1518. ISBN 978-981-02-1440-1. Diarsipkan dari versi asli tanggal 18 Mei 2016. Diakses tanggal 27 September 2022.
- ^ Schadel, M.; Bruchle, W.; Brugger, M.; Gaggeler, H.; Moody, K.; Schardt, D.; Summerer, K.; Hulet, E.; Dougan, A.; Dougan, R.; Landrum, J.; Lougheed, R.; Wild, J.; O'Kelley, G.; Hahn, R. (1986). "Heavy isotope production by multinucleon transfer reactions with 254Es". Journal of the Less Common Metals. 122: 411–417. doi:10.1016/0022-5088(86)90435-2. Diarsipkan dari versi asli tanggal 25 November 2020. Diakses tanggal 27 September 2022.
- ^ Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M.; Moody, K. J.; Gregorich, K. E.; Seaborg, G. T. (1985). "Search for superheavy elements using 48Ca + 254Esg reaction". Physical Review C. 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760. PMID 9953034.
- ^ Turkevich, A. L.; Franzgrote, E. J.; Patterson, J. H. (1967). "Chemical Analysis of the Moon at the Surveyor V Landing Site". Science. 158 (3801): 635–637. Bibcode:1967Sci...158..635T. doi:10.1126/science.158.3801.635. PMID 17732956.
- ^ International Commission on Radiological Protection (1988). Limits for intakes of radionuclides by workers, Part 4. 19. Elsevier Health Sciences. hlm. 18–19. ISBN 978-0-08-036886-3. Diarsipkan dari versi asli tanggal 25 April 2016. Diakses tanggal 27 September 2022.
Bibliografi
sunting- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (edisi ke-2). Butterworth–Heinemann. ISBN 978-0080379418.
- Haire, Richard G. (2006). "Einsteinium". Dalam Morss, Lester R.; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (PDF). 3 (edisi ke-3). Dordrecht, Belanda: Springer. hlm. 1577–1620. doi:10.1007/1-4020-3598-5_12. ISBN 978-1-4020-3555-5. Diarsipkan dari versi asli (PDF) tanggal 17 Juli 2010.
- Holleman, Arnold F.; Wiberg, Nils (2007). Textbook of Inorganic Chemistry (edisi ke-102). Berlin: de Gruyter. ISBN 978-3-11-017770-1.
- Seaborg, G.T., ed. (23 Januari 1978). Proceedings of the Symposium Commemorating the 25th Anniversary of Elements 99 and 100 (PDF). Report LBL-7701.
Pranala luar
sunting- (Inggris) Einsteinium di The Periodic Table of Videos (Universitas Nottingham)
- (Inggris) Faktor terkait usia dalam metabolisme dan dosimetri radionuklida: Prosiding – berisi beberapa studi terkait kesehatan mengenai einsteinium
- (Inggris) WebElements.com - Einsteinium
- (Inggris) Albert Ghiorso mengenai penemuannya

