Raksa(IV) fluorida
Raksa(IV) fluorida, HgF4, adalah senyawa raksa pertama yang ditemukan dengan raksa dalam tingkat oksidasi IV. Raksa, seperti unsur golongan 12 lainnya (kadmium dan seng), memiliki konfigurasi elektron s2d10 dan umumnya hanya membentuk ikatan yang melibatkan orbital s saja. Ini berarti bahwa tingkat oksidasi raksa tertinggi normalnya adalah II, dan untuk alasan ini raksa biasanya dianggap sebagai a logam pasca transisi dan bukan logam transisi.
| |

| |
| Sifat | |
|---|---|
| HgF4 | |
| Massa molar | 276,58 g/mol |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Sejarah
suntingSpekulasi tentang tingkat oksidasi yang lebih tinggi dari raksa telah beredar sejak 1970an, dan kalkulasi teoretis pada 1990an memperkirakan bahwa raksa seharusnya lebih stabil dalam fasa gas, dengan geometri segi empat planar yang konsisten dengan konfigurasi formal d8. Namun, percobaan pembuktian tetap sukar dipahami hingga 2007, ketika HgF4 pertama kali dibuat menggunakan neon dan argon padat untuk isolasi matriks pada temperatur 4 K. Senyawa tersebut dideteksi menggunakan spektroskopi inframerah.[1][2] Analisis teori fungsi rapatan dan perhitungan pasangan kluster (en: coupled cluster) menunjukkan bahwa orbital d terlibat dalam ikatan, mendorong pendapat bahwa raksa seharusnya diakui sebagai logam transisi.[3] Namun, kesimpulan tersebut telah ditentang oleh W.B. Jensen dengan argumen bahwa HgF4 hanya terjadi di bawah kondisi non-kesetimbangan ekstrem dan lebih baik jika dianggap sebagai perkecualian.[4]
Penjelasan
suntingStudi teoretis menyimpulkan bahwa raksa bersifat unik di antara unsur-unsur alami golongan 12 dalam pembentukan tetrafluorida, dan menandai pengamatan ini sebagai efek elativistik. Menurut perhitungan, tetrafluorida dari unsur yang "kurang relativistik" kadmium dan seng tidak stabil dan membebaskan molekul fluor, F2, membentuk kompleks logam difluorida. Sebaliknya, tetrafluorida dari unsur sintetis 112 yang "lebih relativistik", copernicium, diprediksi lebih stabil.[5]
Sentesis dan sifat-sifat
suntingHgF4 diproduksi dari reaksi unsur raksa dengan fluor:
- Hg + 2 F2 → HgF4
HgF4 hanya stabil dalam isolasi matriks pada 4 K; pada pemanasan, atau jika molekul HgF4 bersinggungan satu sama lain, akan terdekomposisi menjadi raksa(II) fluorida dan fluor:
- HgF4 → HgF2 + F2
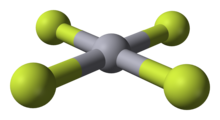
HgF4 bersifat diamagnetik, molekul segiempat planar. Atom raksa memiliki konfigurasi elektron 6s25d86p6, dan mematuhi kaidah oktet tetapi tidak kaidah elektron 18. HgF4 is isoelektronik dengan anion tetrafluoroaurat, AuF−
4AuF−4, dan valensi isoelektronik dengan anion tetrakloroaurat (AuCl−
4AuCl−4), tetrabromoaurat (AuBr−
4AuBr−4), dan tetrakloroplatinat (PtCl2−
4PtCl2−4).
Referensi
sunting- ^ "High Oxidation States: Mercury tetrafluoride synthesized" Diarsipkan 2011-07-19 di Wayback Machine..
- ^ "Elusive Hg(IV) species has been synthesized under cryogenic conditions". 2007-10-12.
- ^ Xuefang Wang; Lester Andrews; Sebastian Riedel; Martin Kaupp (2007), "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4", Angew. Chem. Int. Ed., 46 (44): 8371–8375, doi:10.1002/anie.200703710, PMID 17899620
- ^ William B. Jensen (2008), "Is Mercury Now a Transition Element?", J. Chem. Educ., 85 (9): 1182–1183, doi:10.1021/ed085p1182
- ^ Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006), "Transactinides and the future elements", dalam Morss; Edelstein, Norman M.; Fuger, Jean, The Chemistry of the Actinide and Transactinide Elements (edisi ke-3rd), Dordrecht, The Netherlands: Springer Science+Business Media, ISBN 1-4020-3555-1