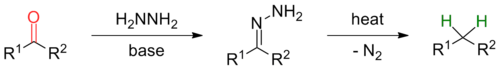
Reduksi Wolff–Kishner
Reduksi Wolff–Kishner adalah suatu reaksi yang digunakan dalam kimia organik untuk mengubah gugus fungsional karbonil menjadi gugus metilena. Dalam konteks sintesis molekul kompleks, reaksi ini paling sering digunakan menghilangkan gugus karbonil setelah mengalami maksud dan tujuan sintetis dari aktivasi zat antara dalam tahapan sebelumnya. Dengan demikian, tidak ada retron yang jelas untuk reaksi ini. Awalnya dilaporkan oleh Nikolai Kischner pada tahun 1911[1] dan Ludwig Wolff pada tahun 1912,[2] reaksi ini telah diterapkan pada sintesis total asam skopadulsat B,[3] aspidospermidina[4][5] dan disidiolida.[6]
| Reduksi Wolff-Kishner | |
|---|---|
| Dinamai berdasarkan | Ludwig Wolff Nikolai Kischner |
| Jenis reaksi | Reaksi redoks organik |
| Pengenal | |
| Portal Organic Chemistry | wolff-kishner-reduction |
| ID ontologi RSC | RXNO:0000226 |
Karena reduksi Wolff–Kishner membutuhkan kondisi yang sangat basa, reaksi ini tidak cocok bagi substrat yang sensitif terhadap basa. Namun, metode ini lebih baik dibandingkan reduksi Clemmensen untuk senyawa yang sentitif terhadap asam seperti pirola dan sneyawa dengan berat molekul yang tinggi.
Sejarah
suntingReduksi Wolff–Kishner ditemukan secara independen oleh N. Kishner[1] pada tahun 1911 dan L. Wolff pada tahun 1912.[2] Kishner menemukan bahwa penambahan hidrazon pra-pembuatan ke dalam suatu kalium hidroksida panas mengandung pelat berpori berlapis platina yang dihancurkan menyebabkan pembentukan hidrokarbon yang sesuai. Sebuah ulasan yang berjudul “Disability, Despotism, Deoxygenation—From Exile to Academy Member: Nikolai Matveevich Kizhner” memaparkan kehidupan dan karya Kishner dipublikasikan pada tahun 2013.[7]
Wolff kemudian melakukan hasil yang sama dengan memanaskan larutan etanol dari semikarbazon atau hidrazon dalam tabung tertutup pada suhu 180 °C dalam kehadiran natrium etoksida.
Mekanisme reaksi
suntingSecara umum, mekanisme reaksi pertama kali melibatkan pembentukan hidrazon secara in situmelalui kondensasi hidrazin dengan keton atau aldehida sebagai substrat. Terkadang, namun, dapat menguntungkan untuk menggunakan hidrazon pra-terbentuk sebagai substrat (lihat modifikasi). Hidrazon terdeprotonasi oleh basa alkoksida diikuti dengan tahap penentu laju reaksi, secara serentak yang mana suatu anion diimida terbentuk. Rusaknya alkildiimida ini dengan lepasnya N2 mengarah pada pembentukan suatu alkilanion yang dapat diprotonasi dengan pelarut untuk memberikan produk yang diinginkan.
Modifikasi
suntingBanyak upaya yang ditujukan untuk meningkatkan reduksi Wolff-Kishner telah difokuskan pada pembentukan yang lebih efisien pada zat antara hidrazon melalui pelepasan air dan laju yang lebih cepat dari dekomposisi hidrazon dengan meningkatkan suhu reaksi.[8][9] Beberapa modifikasi baru memberikan kemajuan yang lebih penting dan memungkinkan untuk reaksi dalam kondisi yang jauh lebih ringan. Tabel berikut menunjukkan ringkasan beberapa modifikasi yang telah dikembangkan sejak penemuan awal.
| Prosedur awal[1][2] | Huang Minlon[10][11] | Barton[12] | Cram[13] | Henbest[14] | Caglioti[15][16] | Myers[17] | |
|---|---|---|---|---|---|---|---|
| Pereaksi | senyawa karbonil, 100% H2NNH2, Na atau NaOEt | senyawa karbonil, 85% H2NNH2, KOH | senyawa karbonil, H2NNH2 anhidrat, Na | hidrazon pra-pembuatan, KOtBu | hidrazon pra-pembuatan, KOtBu | tosilhydrazon, donor hidrida | senyawa karbonil, 1,2-bis(tert-butildimetilsilil)- hidrazin, Sc(OTf)3, KOtBu |
| Pelarut | pelarut dengan titik didih tinggi, seperti etilen glikol | pelarut dengan titik didih tinggi, seperti etilen glikol | pelarut dengan titik didih tinggi, seperti dietilen glikol | anh. DMSO | toluena | THF | DMSO |
| Suhu | 200 °C | 180–200 °C (setelah pelepasan air dan hidrazin berlebih) | 210 °C | 25 °C | 111 °C | 66 °C | 25 °C |
| Keuntungan | prosedur satu tahap | mengurangi waktu reaksi, suhu yang lebih tinggi dapat dicapai, tidak perlu menggunakan anh. hidrazin | memungkinkan dekarbonilasi substrat yang terhalang secara sterik | dilakukan pada suhu kamar | tidak perlu penambahan lambat hidrazon | kondisi ringan reaksi, tidak ada basa yang diperlukan, dimungkinkan dengan berbagai agen pereduksi | kondisi reaksi yang sangat ringan |
| Kerugian | waktu reaksi yang lama (50–100 jam) | membutuhkan distilasi | kondisi reaksi yang keras | isolasi hidrazon dan penambahan lambat diperlukan | isolasi hidrazon diperlukan | isolasi tosilhidrazon diperlukan | sintesis 1,2-bis(tert-butildimetilsilil)- hidrazin diperlukan |
| Toleransi gugus fungsi | tidak mentoleransi ester, amida, halogen, siano-, dan gugus nitro- | sama dengan prodesur asli | sama dengan prodesur asli | mentoleransi amida | toleransi tinggi terhadap substituen-α yang akan mengalami eliminasi dan enon tak jenuh-α,β yang akan mengalami migrasi pada kondisi aslinya | mentoleransi ester, amida, substituen siano-, nitro- dan kloro- dengan NaBH3CN sebagai sumber hidrida, tidak mentoleransi substituen bromo- dan iodo- primer | tidak dilaporkan |
Lihat pula
suntingReferensi
sunting- ^ a b c Kishner, N (1911). "Wolff–Kishner reduction; Huang–Minlon modification". J. Russ. Phys. Chem. Soc. 43: 582–595.
- ^ a b c Wolff, L. (1912). "Chemischen Institut der Universität Jena: Methode zum Ersatz des Sauerstoffatoms der Ketone und Aldehyde durch Wasserstoff. [Erste Abhandlung.]". Justus Liebig's Annalen der Chemie. 394: 86–108. doi:10.1002/jlac.19123940107.
- ^ Overman, L. E.; Ricca, D. J.; Tran, V. D. (1993). "First total synthesis of scopadulcic acid B". Journal of the American Chemical Society. 115 (5): 2042. doi:10.1021/ja00058a064.
- ^ Marino, J. P.; Rubio, M. B.; Cao, G.; De Dios, A. (2002). "Total Synthesis of (+)-Aspidospermidine: A New Strategy for the Enantiospecific Synthesis of Aspidosperma Alkaloids". Journal of the American Chemical Society. 124 (45): 13398–13399. doi:10.1021/ja026357f. PMID 12418888.
- ^ Kawano, M.; Kiuchi, T.; Negishi, S.; Tanaka, H.; Hoshikawa, T.; Matsuo, J. I.; Ishibashi, H. (2013). "Regioselective Inter- and Intramolecular Formal \4+2] Cycloaddition of Cyclobutanones with Indoles and Total Synthesis of (±)-Aspidospermidine". Angewandte Chemie International Edition. 52 (3): 906. doi:10.1002/anie.201206734. PMID 23184896.
- ^ Miyaoka, H.; Kajiwara, Y.; Hara, Y.; Yamada, Y. (2001). "Total Synthesis of Natural Dysidiolide". The Journal of Organic Chemistry. 66 (4): 1429–1435. doi:10.1021/jo0015772. PMID 11312976.
- ^ Lewis, D. E. (2013). "Disability, Despotism, Deoxygenation-From Exile to Academy Member: Nikolai Matveevich Kizhner". Angewandte Chemie International Edition. 52 (45): 11704–11712. doi:10.1002/anie.201303165.
- ^ Herr, C. H.; Whitmore, F. C.; Schiessler, R. W. (1945). "The Wolff-Kishner Reaction at Atmospheric Pressure". Journal of the American Chemical Society. 67 (12): 2061. doi:10.1021/ja01228a002.
- ^ Soffer, M. D.; Soffer, M. B.; Sherk, K. W. (1945). "A Low Pressure Method for Wolff—Kishner Reduction". Journal of the American Chemical Society. 67 (9): 1435. doi:10.1021/ja01225a004.
- ^ Huang-Minlon, [N. A. (1946). "A Simple Modification of the Wolff-Kishner Reduction". Journal of the American Chemical Society. 68 (12): 2487. doi:10.1021/ja01216a013.
- ^ Huang-Minlon, [N. A. . (1949). "Reduction of Steroid Ketones and other Carbonyl Compounds by Modified Wolff--Kishner Method". Journal of the American Chemical Society. 71 (10): 3301. doi:10.1021/ja01178a008.
- ^ Osdene, T. S.; Timmis, G. M.; Maguire, M. H.; Shaw, G.; Goldwhite, H.; Saunders, B. C.; Clark, E. R.; Epstein, P. F.; Lamchen, M.; Stephen, A. M.; Tipper, C. F. H.; Eaborn, C.; Mukerjee, S. K.; Seshadri, T. R.; Willenz, J.; Robinson, R.; Thomas, A. F.; Hickman, J. R.; Kenyon, J.; Crocker, H. P.; Hall, R. H.; Burnell, R. H.; Taylor, W. I.; Watkins, W. M.; Barton, D. H. R.; Ives, D. A. J.; Thomas, B. R. (1955). "Notes". Journal of the Chemical Society (Resumed): 2038. doi:10.1039/JR9550002038.
- ^ Cram, D. J.; Sahyun, M. R. V. (1962). "Room Temperature Wolff-Kishner Reduction and Cope Elimination Reactions". Journal of the American Chemical Society. 84 (9): 1734. doi:10.1021/ja00868a048.
- ^ Grundon, M. F.; Henbest, H. B.; Scott, M. D. (1963). "344. The reactions of hydrazones and related compounds with strong bases. Part I. A modified Wolff?Kishner procedure". Journal of the Chemical Society (Resumed): 1855. doi:10.1039/JR9630001855.
- ^ Caglioti, L.; Magi, M. (1963). "The reaction of tosylhydrazones with lithium aluminium hydride". Tetrahedron. 19 (7): 1127. doi:10.1016/S0040-4020(01)98571-0.
- ^ Caglioti, L. (1966). "The reduction of tosylhydrazones and of acyl tosylhydrazides". Tetrahedron. 22 (2): 487–493. doi:10.1016/0040-4020(66)80015-7.
- ^ Furrow, M. E.; Myers, A. G. (2004). "Practical Procedures for the Preparation ofN-tert-Butyldimethylsilylhydrazones and Their Use in Modified Wolff−Kishner Reductions and in the Synthesis of Vinyl Halides andgem-Dihalides". Journal of the American Chemical Society. 126 (17): 5436–5445. doi:10.1021/ja049694s. PMID 15113215.
Bacaan lebih lanjut
sunting- Todd, D. The Wolff-Kishner Reduction. In Org. React. (eds. Adams, E.); John-Wiley & Sons, Inc.: London, 1948, 4, 378
- Hutchins, R. O. Reduction of C=X to CH2 by Wolff-Kishner and Other Hydrazone Methods. In Comp. Org. Synth. (eds. Trost, B. M., Fleming, I.); Pergamon: Oxford, 1991, 8, 327