Enfuvirtid
Enfuvirtid (INN) adalah penghambat fusi HIV, yang pertama dari kelas obat antiretroviral yang digunakan dalam terapi kombinasi untuk pengobatan HIV/AIDS.
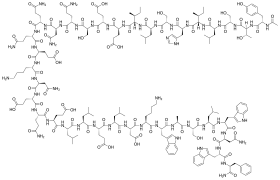
| |
|---|---|
| Data klinis | |
| Nama dagang | Fuzeon |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a603023 |
| Data lisensi | US Daily Med:pranala |
| Kat. kehamilan | B2(AU) |
| Status hukum | Harus dengan resep dokter (S4) (AU) ℞-only (CA) POM (UK) ℞-only (US) |
| Rute | subkutan |
| Data farmakokinetik | |
| Bioavailabilitas | 84,3% (subkutan) |
| Ikatan protein | 92% |
| Metabolisme | Hati |
| Waktu paruh | 3,8 jam |
| Ekskresi | tidak diketahui |
| Pengenal | |
| Nomor CAS | 159519-65-0 |
| Kode ATC | J05AX07 |
| PubChem | CID 16130199 |
| DrugBank | DB00109 |
| ChemSpider | 16743716 |
| UNII | 19OWO1T3ZE |
| KEGG | D02499 |
| ChEBI | CHEBI:608828 |
| ChEMBL | CHEMBL525076 |
| NIAID ChemDB | AIDSNO:059486 |
| Data kimia | |
| Rumus | C204H301N51O64 |
| SMILES | eMolecules & PubChem |
| |
Sejarah
Enfuvirtid berasal dari Universitas Duke, tempat para peneliti membentuk perusahaan farmasi yang dikenal sebagai Trimeris. Trimeris mulai mengembangkan enfuvirtid pada tahun 1996 dan awalnya menyebutnya T-20. Pada tahun 1999, Trimeris menjalin kemitraan dengan Hoffmann-La Roche untuk menyelesaikan pengembangan obat tersebut. Obat ini disetujui oleh Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) pada tanggal 13 Maret 2003[1]
Kegunaan dalam medis
Enfuvirtide diindikasikan untuk pengobatan infeksi HIV-1, dalam terapi kombinasi dengan antiretroviral lain, pada orang yang semua pengobatan lain telah gagal.[2]
Efek samping
Reaksi obat yang tidak diinginkan yang umum (≥1% pasien) yang terkait dengan terapi enfuvirtid meliputi: reaksi pada tempat suntikan (nyeri, pengerasan kulit, eritema, nodul, kista, gatal; dialami oleh hampir semua pasien, terutama pada minggu pertama), neuropati perifer, insomnia, gangguan depresi mayor, batuk, dispnea, anoreksia, artralgia, infeksi (termasuk pneumonia bakteri) dan/atau eosinofilia. Berbagai reaksi hipersensitivitas jarang terjadi (0,1–1% pasien), gejalanya meliputi ruam, demam, mual, muntah, menggigil, hipotensi, peningkatan transaminase hati; dan kemungkinan reaksi yang lebih parah termasuk gangguan pernapasan, glomerulonefritis dan/atau anafilaksis. Pemberian ulang tidak direkomendasikan.[2]
Farmakologi
Referensi
- ^ "Drugs@FDA: FDA Approved Drug Products – Fuzeon (Click on 'Approval Date(s) and History, Letters, Labels, Reviews for NDA 021481')". accessdata.fda.gov. United States Food and Drug Administration. Diarsipkan dari versi asli tanggal 28 June 2017. Diakses tanggal 6 January 2019.
- ^ a b Rossi S, ed. (2006). Australian Medicines Handbook. Adelaide: Australian Medicines Handbook Pty Ltd. ISBN 0-9757919-2-3.