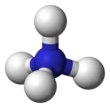
Amonium
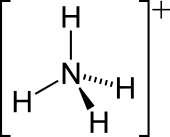
Kation amonium adalah ion poliatomik bermuatan positif dengan rumus kimia NH.[1] Ia terbentuk melalui protonasi amonia (NH3). Amonium juga merupakan nama umum untuk amina tersubstitusi melalui protonasi atau bermuatan positif dan kation amonium kuarterner (NR), yang satu atau lebih atom hidrogennya digantikan oleh gugus organik (ditandai dengan lambang R).
| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (sistematis)
Ammonium | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| MeSH | D000644 | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| N | |||
| Massa molar | 18,04 g·mol−1 | ||
| Keasaman (pKa) | 9,25 | ||
| Struktur | |||
| Tetrahedral | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Sifat asam basa
Ion amonium terbentuk ketika amonia, suatu basa lemah, bereaksi dengan asam Brønsted (donor proton):
Ion amonium adalah asam lemah, bereaksi dengan basa Brønsted menghasilkan kembali molekul amonia yang tak bermuatan:
Sehingga, perlakuan larutan pekat garam amonium dengan basa kuat menghasilkan amonia. Ketika amonia dilarutkan dalam air, sejumlah kecil amonia berubah menjadi ion amonium:
Amonia membentuk ion amonium bergantung pada pH larutan. Jika pH rendah, kesetimbangan bergeser ke kanan: lebih banyak ion amonium yang terbentuk. Jika pH tinggi (konsentrasi ion hidrogen rendah), kesetimbangan bergeser ke kiri: ion hidroksida menarik proton dari ion amonium, menghasilkan amonia.
Pembentukan senyawa amonium dapat juga terjadi dalam fase uap; misalnya, ketika uap amonia terkena uap hidrogen klorida, terbentuk kabut putih amonium klorida, yang akhirnya mengendap sebagai lapisan padatan putih pada permukaan.
Perubahan amonium kembali ke amonia mudah dicapai dengan penambahan basa kuat.
Garam amonium
Kation amonium digemukan dalam beragam garam seperti amonium karbonat, amonium klorida, dan amonium nitrat. Garam amonium paling sederhana sangat mudah larut dalam air, kecuali amonium heksakloroplatinat, yang pembentukannya pernah digunakan sebagai uji amonium. Garam amonium dari nitrat dan terutama perklorat sangat mudah meledak, dalam hal ini amonium adalah reduktor.
Dalam suatu proses normal, ion amonium membentuk amalgam. Spesies semacam ini disiapkan melalui elektrolisis larutan amonium menggunakan katode raksa.[2] This amalgam eventually decomposes to release ammonia and hydrogen.[3]
Struktur dan ikatan
Pasangan elektron sunyi pada atom nitrogen (N) dalam amonia, ditandai dengan garis di atas N, membentuk ikatan dengan proton (H+). Kemudian, empat ikatan N–H seluruhnya ekivalen, menjadi ikatan kovalen polar. Ion amonium memiliki struktur tetrahedral dan isoelektronik dengan metana dan borohidrida. Dari sisi ukuran, kation amonium (rion = 175 pm) mendekati kation sesium (rion = 183 pm).
Ion amonium organik
Atom hidrogen dalam ion amonium dapat disubstitusi dengan gugus alkil atau gugus organik lainnya membentuk ion amonium tersubstitusi (tata nama IUPAC: ion aminium). Sesuai jumlah gugus organiknya, kation amonium disebut primer, sekunder, tersier, atau kuarterner. Selain kation kuarterner, kation amonium organik adalah asam lemah.
Contoh reaksi pembentukan ion amonium adalah antara dimetilamina, (CH''";, dan suatu asam, menghasilkan kation dimetilaminium, (CH''";:
Kation amonium kuarterner memiliki empat gugus organik yang terikat pada atom nitrogen. Ia tidak memiliki atom hidrogen yang melekat pada atom nitrogen. Kation ini, seperti kation tetra-n-butilamonium, kadang-kadang digunakan untuk menggantikan ion natrium atau kalium untuk meningkatkan kelarutan anion terkait dalam pelarut organik. Garam amonium primer, sekunder, dan tersier bertindak dengan fungsi yang sama, tetapi kurang lipofil. Mereka juga digunakan sebagai katalis transfer fasa dan surfaktan.
Suatu kelompok garam amonium organik yang kurang umum adalah turunan dari kation radikal amina, R. Salah satu contohnya adalah tris(4-bromofenil)amonium heksakloroantimonat.
Biologi
Ion amonium adalah limbah metabolisme hewan. Pada ikan dan invertebrata akuatik, ia diekskresikan langsung ke perairan. Pada mamalia, hiu, dan amfibi, ia diubah menjadi urea melalui siklus urea, karena urea kurang toksik dan dapat disimpan dengan lebih efisien. Pada burung, reptil, dan siput tanah, amonium metabolik diubah menjadi asam urat, yang berbentuk padat sehingga dapat diekskresikan tanpa kehilangan banyak air.[4]
Amonium adalah sumber penting nitrogen untuk banyak spesies tumbuhan, terutama yang tumbuh di tanah hipoksia. Namun, ia juga beracun bagi sebagian besar tumbuhan budidaya dan jarang diberikan sebagai sumber nitrogen tunggal.[5]
Logam amonium
Ion amonium memiliki sifat yang sangat mirip dengan logam alkali berat dan sering dianggap memiliki kedekatan.[6][7][8] Amonium dianggap berperilaku sebagai logam (NH dalam lautan elektron) pada tekanan yang sangat tinggi, seperti di dalam planet gas raksasa semacam Uranus dan Neptunus.[7][8]
Pada kondisi normal, amonium tidak berada sebagai logam murni, tetapi terdapat sebagai amalgam (paduan dengan raksa).[9]
Lihat juga
Referensi
- ^ Dalam tatanama substitutif, NH ditandai dengan nama "azanium".
- ^ Pseudo-binary compounds
- ^ "Ammonium Salts". VIAS Encyclopedia.
- ^ Campbell, Neil A.; Jane B. Reece (2002). "44". Biology (edisi ke-6th). San Francisco: Pearson Education, Inc. hlm. 937–938. ISBN 0-8053-6624-5.
- ^ Britto, DT; Kronzucker, HJ (2002). "NH4+ toxicity in higher plants: a critical review" (PDF). Journal of Plant Physiology. 159 (6): 567–584. doi:10.1078/0176-1617-0774.
- ^ Holleman, A. F.; Wiberg, E. (2001), Inorganic Chemistry, San Diego: Academic Press, ISBN 0-12-352651-5
- ^ a b Stevenson, D. J. (November 20, 1975). "Does metallic ammonium exist?". Nature. Nature Publishing Group. 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. Diakses tanggal January 13, 2012.
- ^ a b Bernal, M. J. M.; Massey, H. S. W. (February 3, 1954). "Metallic Ammonium" (PDF). Monthly Notices of the Royal Astronomical Society. Wiley-Blackwell for the Royal Astronomical Society. 114 (2): 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172. Diakses tanggal January 13, 2012.
- ^ Reedy, J.H. (October 1, 1929). "Lecture demonstration of ammonium amalgam". Journal of Chemical Education. 6 (10): 1767. doi:10.1021/ed006p1767. Diakses tanggal October 28, 2015.