Eslikarbazepin asetat
Eslikarbazepin asetat (disingkat ESL), yang dijual dengan merek dagang Aptiom dan Zebinix, adalah obat antikonvulsan yang disetujui untuk digunakan di Eropa dan Amerika Serikat sebagai monoterapi atau sebagai terapi tambahan untuk epilepsi dengan sawan parsial.[2][3][4]
| |
|---|---|
| Nama sistematis (IUPAC) | |
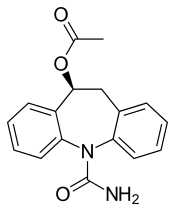
| (S)-10-Asetoksi-10,11-dihidro-5H-dibenz[b,f]azepina-5-karboksamida | |
| Data klinis | |
| Nama dagang | Aptiom, Zebinix, Exalief |
| AHFS/Drugs.com | monograph |
| Data lisensi | EMA:pranala |
| Kat. kehamilan | D(AU) |
| Status hukum | Harus dengan resep dokter (S4) (AU) ℞-only (CA) ℞-only (US) ℞ Preskripsi saja |
| Rute | Oral |
| Data farmakokinetik | |
| Ikatan protein | ~30%[1] |
| Metabolisme | UGT (?) |
| Waktu paruh | 10–20 jam |
| Ekskresi | ~90% (ginjal) |
| Pengenal | |
| Nomor CAS | 236395-14-5 |
| Kode ATC | N03AF04 |
| PubChem | CID 179344 |
| DrugBank | DB09119 |
| ChemSpider | 156110 |
| UNII | BEA68ZVB2K |
| KEGG | D09612 |
| ChEBI | CHEBI:87016 |
| ChEMBL | CHEMBL87992 |
| Data kimia | |
| Rumus | C17H16N2O3 |
| SMILES | eMolecules & PubChem |
| |
Mirip dengan okskarbazepin, ESL berfungsi sebagai obat pendahulu (S)-(+)-likarbazepin.[5] Dengan demikian, mekanisme kerja keduanya identik.[6]
Sejarah
Eslikarbazepin asetat dikembangkan oleh perusahaan farmasi Portugis Bial. Pada awal tahun 2009, Bial menjual hak pemasaran di Eropa kepada perusahaan Jepang Eisai.[7] Obat ini disetujui di Uni Eropa pada bulan April 2009 dengan nama dagang Zebinix dan Exalief, tetapi dipasarkan hanya dengan nama depan.[8][9] Di AS, obat ini dipasarkan oleh Sunovion (sebelumnya Sepracor) dan disetujui pada bulan November 2013.[2]
Kontraindikasi
Efek samping
Overdosis
Interaksi
Farmakologi
Kimia
Penelitian
Studi tentang penggunaan ESL sebagai antikonvulsan untuk anak-anak sedang dilakukan sejak tahun 2016.[10]
Penilaian tahun 2015 menunjukkan tidak ada perbedaan statistik dengan plasebo untuk gangguan yang terakhir.[11]
Referensi
- ^ Dinnendahl V, Fricke U, ed. (2011). Arzneistoff-Profile (dalam bahasa German). 4 (edisi ke-25). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
- ^ a b "FDA approves Aptiom to treat seizures in adults". US FDA. 8 November 2013. Diarsipkan dari versi asli tanggal 11 January 2017. Diakses tanggal 16 December 2019.
- ^ "Zebinix EPAR". European Medicines Agency (EMA). Diakses tanggal 21 January 2021.
- ^ "Aptiom- eslicarbazepine acetate tablet Aptiom- eslicarbazepine acetate kit". DailyMed. Diakses tanggal 21 January 2021.
- ^ Rogawski MA (June 2006). "Diverse mechanisms of antiepileptic drugs in the development pipeline". Epilepsy Research. 69 (3): 273–94. doi:10.1016/j.eplepsyres.2006.02.004. PMC 1562526 . PMID 16621450.
- ^ Rogawski MA, Löscher W (July 2004). "The neurobiology of antiepileptic drugs". Nature Reviews. Neuroscience. 5 (7): 553–64. doi:10.1038/nrn1430. PMID 15208697.
- ^ "Eisai and Bial Announce Partnership Agreement for the European Commercialisation of the Novel Once Daily Anti-Epileptic Zebinix". PR Newswire. 19 February 2009.
- ^ "Summary of Product Characteristics for Zebinix" (PDF). European Medicines Agency. hlm. 14. Diarsipkan dari versi asli (PDF) tanggal 2018-09-20. Diakses tanggal 2016-05-22.
- ^ "Exalief (eslicarbazepine acetate): Expiry of the marketing authorisation in the European Union" (PDF). European Medicines Agency. 30 July 2012. Diarsipkan dari versi asli (PDF) tanggal 20 September 2018. Diakses tanggal 22 May 2016.
- ^ Nomor uji klinis NCT00988156 for "Eslicarbazepine Acetate (BIA 2 093) as Therapy for Refractory Partial Seizures in Children" di ClinicalTrials.gov
- ^ Grunze H, Kotlik E, Costa R, Nunes T, Falcão A, Almeida L, Soares-da-Silva P (March 2015). "Assessment of the efficacy and safety of eslicarbazepine acetate in acute mania and prevention of recurrence: experience from multicentre, double-blind, randomised phase II clinical studies in patients with bipolar disorder I". Journal of Affective Disorders. 174: 70–82. doi:10.1016/j.jad.2014.11.013. PMID 25484179.
Pranala luar
- "Eslicarbazepine acetate". Drug Information Portal. U.S. National Library of Medicine.