Etanersept
Etanersept adalah produk medis biologis yang digunakan untuk mengobati penyakit autoimun dengan mengganggu faktor nekrosis tumor-alfa (TNF-α), sitokin inflamasi yang larut, dengan bertindak sebagai penghambat TNF. Produk ini telah mendapat persetujuan dari Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) untuk mengobati rheumatoid arthritis, artritis idiopatik juvenil, dan artritis psoriatis, psoriasis plak, dan ankilosing spodilitis. Faktor nekrosis tumor alfa (TNFα) adalah "pengatur utama" respons inflamasi (imun) di banyak sistem organ. Penyakit autoimun disebabkan oleh respons imun yang terlalu aktif. Etanersept berpotensi untuk mengobati penyakit ini dengan menghambat TNF-alfa.[1]
| |
|---|---|
| Data klinis | |
| Nama dagang | Enbrel |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a602013 |
| Data lisensi | US Daily Med:pranala |
| Kat. kehamilan | D(AU) |
| Status hukum | Harus dengan resep dokter (S4) (AU) ℞-only (CA) POM (UK) ℞-only (US) |
| Rute | Subkutan |
| Data farmakokinetik | |
| Bioavailabilitas | 58–76% (subkutan) |
| Waktu paruh | 70–132 jam |
| Pengenal | |
| Nomor CAS | 185243-69-0 |
| Kode ATC | L04AB01 |
| PubChem | SID7847807 |
| DrugBank | DB00005 |
| ChemSpider | None |
| UNII | OP401G7OJC |
| KEGG | D00742 |
| ChEMBL | CHEMBL1201572 |
| Data kimia | |
| Rumus | C2224H3475N621O698S36 |
Etanersept adalah protein fusi yang diproduksi oleh DNA rekombinan. Protein ini menggabungkan reseptor TNF dengan ujung konstan antibodi IgG1. Pertama, para pengembang mengisolasi urutan DNA yang mengkode gen manusia untuk reseptor TNF 2 yang larut, yaitu reseptor yang mengikat faktor nekrosis tumor-alfa. Kedua, mereka mengisolasi urutan DNA yang mengkode gen manusia untuk ujung Fc imunoglobulin G1 (IgG1). Ketiga, mereka menghubungkan DNA untuk reseptor TNF 2 dengan DNA untuk Fc IgG1. Terakhir, mereka mengekspresikan DNA yang terhubung untuk menghasilkan protein yang menghubungkan protein untuk reseptor TNF 2 dengan protein untuk Fc IgG1.[2]
Protein fusi prototipe pertama kali disintesis dan terbukti sangat aktif dan sangat stabil sebagai modalitas untuk blokade TNF in vivo pada awal tahun 1990-an oleh Bruce A. Beutler, seorang peneliti akademis di Universitas Pusat Medis Barat Daya Texas di Dallas, dan rekan-rekannya.[3][4]
Para peneliti ini juga mematenkan protein tersebut,[5] dan menjual semua hak atas penggunaannya kepada Immunex, sebuah perusahaan bioteknologi Seattle yang diakuisisi oleh Amgen pada tahun 2002.[6]
Protein ini merupakan molekul besar, dengan berat molekul 150 dalton, yang mengikat TNFα dan mengurangi perannya dalam gangguan yang melibatkan peradangan berlebih pada manusia dan hewan lainnya, termasuk penyakit autoimun seperti ankilosing spondilitis,[7] rheumatoid arthritis juvenil, psoriasis, arthritis psoriasis, rheumatoid arthritis, dan berpotensi dalam berbagai gangguan lain yang dimediasi oleh kelebihan TNFα. Protein ini tercantum dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[8]
Sejarah
suntingPaten pertama yang terkait dengan etanersept diajukan oleh Immunex pada bulan September 1989.[9] Protein fusi tersebut dikembangkan oleh Bruce A. Beutler, seorang peneliti akademis di Universitas Pusat Medis Barat Daya Texas di Dallas, dan rekan-rekannya, yang mematenkannya dan melisensikan haknya pada tahun 1995 kepada Immunex.[10] Paten lain untuk teknologi protein fusi tersebut dari Brian Seed di Rumah Sakit Umum Massachusetts dilisensikan kepada Immmunex pada tahun 1997.[11]
Etanersept disetujui untuk digunakan di Amerika Serikat pada bulan November 1998.[12][13]
Etanersept disetujui untuk digunakan di Uni Eropa pada bulan Februari 2000.[14]
Kegunaan dalam medis
suntingDi Amerika Serikat, etanersept diindikasikan untuk:
- Rheumatoid arthritis (RA) Sedang hingga Berat (November 1998)[12][15]
- Rheumatoid arthritis juvenil Poliartikular Sedang hingga Berat (Mei 1999)[12][16]
- Arthritis Psoriasis (Januari 2002)[12][17]
- Ankilosing spodilitis (AS) (Juli 2003)[12][18][19]
- Psoriasis Plak Sedang hingga Berat (April 2004)[12][20]
Di Uni Eropa, etanersept diindikasikan untuk mengobati:
- Rheumatoid arthritis aktif sedang hingga berat[14]
- Rheumatoid arthritis berat, aktif, dan progresif[14]
- Artritis idiopatik juvenil[14]
- Poliartritis (faktor rheumatoid positif atau negatif) dan oligoartritis yang meluas pada anak-anak dan remaja[14]
- artritis psoriatis aktif dan progresif[14]
- artritis terkait entesitis
- spondiloartritis aksial[14]
- spondilitis ankilosa aktif yang parah[14]
- spondiloartritis aksial non-radiografik yang parah[14]
- psoriasis plak sedang hingga parah[14]
- psoriasis plak kronis parah psoriasis plak pediatrik[14]
Penggunaan yang tidak diketahui
suntingSeorang dokter Amerika Serikat, Edward Tobinick, telah mencoba menggunakan etanersept untuk mengobati disfungsi neurologis kronis setelah strok dan cedera otak[21] dan telah mengeluarkan paten AS[22] dan asing. Dalam tulisannya untuk Science-Based Medicine, Steven Novella mengatakan bahwa "tidak etis bagi dokter untuk berpraktik di luar area kompetensi dan keahlian mereka". Tobinick menggugat Novella sebagai tanggapan, dan kalah.[23] Mengenai pengobatan ini, American Academy of Neurology menyarankan "tidak ada cukup bukti untuk menentukan efektivitasnya dan bahwa pengobatan tersebut mungkin dikaitkan dengan hasil yang buruk dan biaya yang tinggi".[24]
Efek samping
suntingPada tanggal 2 Mei 2008, Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) memberikan peringatan kotak hitam pada etanersept karena sejumlah infeksi serius yang terkait dengan obat tersebut.[25] Infeksi serius dan sepsis termasuk kematian, telah dilaporkan akibat penggunaan etanersept termasuk reaktivasi infeksi tuberkulosis laten dan hepatitis B.[12][26]
Reaksi di tempat suntikan seperti kemerahan dan nyeri adalah hal yang umum, terjadi pada sekitar 11,4% kasus.[27]
Mekanisme kerja
suntingEtanersept mengurangi efek TNF yang ada secara alami, dan karenanya merupakan penghambat TNF, yang berfungsi sebagai reseptor umpan yang mengikat TNF.[28]
Faktor nekrosis tumor-alfa (TNFα) adalah sitokin yang diproduksi oleh limfosit dan makrofag, dua jenis sel darah putih. Ia memediasi respons imun dengan menarik sel darah putih tambahan ke lokasi peradangan dan melalui mekanisme molekuler tambahan yang memulai dan memperkuat peradangan. Penghambatan aksinya oleh etanersept mengurangi respons peradangan, yang sangat berguna untuk mengobati penyakit autoimun.
Ada dua jenis reseptor TNF: yang ditemukan tertanam dalam sel darah putih yang merespons TNF dengan melepaskan sitokin lain, dan reseptor TNF terlarut yang digunakan untuk menonaktifkan TNF dan menumpulkan respons imun. Selain itu, reseptor TNF ditemukan pada permukaan hampir semua sel berinti (sel darah merah, yang tidak berinti, tidak mengandung reseptor TNF pada permukaannya). Etanersept meniru efek penghambatan reseptor TNF terlarut yang terjadi secara alami, perbedaannya adalah etanersept, karena merupakan protein fusi dan bukan reseptor TNF sederhana, memiliki waktu paruh yang jauh lebih lama di aliran darah, dan oleh karena itu efek biologisnya lebih mendalam dan tahan lama daripada reseptor TNF terlarut yang terjadi secara alami.[29]
Struktur
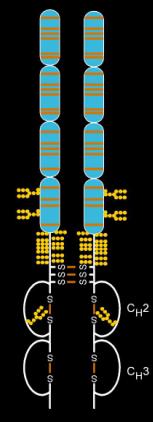
suntingEtanersept dibuat dari kombinasi dua reseptor TNF manusia 75 kilodalton yang larut secara alami yang dihubungkan ke bagian Fc dari IgG1.[30] Efeknya adalah protein fusi dimerik yang direkayasa secara artifisial.[30] Etanersept adalah molekul kompleks yang mengandung 6 N-glikana, hingga 14 O-glikana dan 29 struktur jembatan disulfida.[31][32][33]
Dalam budaya masyarakat
suntingEkonomi
suntingHarga eceran etanersept di AS telah meningkat dari waktu ke waktu. Pada tahun 2008, biaya etanersept adalah $1.500 per bulan atau $18.000 per tahun.[34] Pada tahun 2011, biaya tersebut telah melampaui $20.000 per tahun.[35][36] Pada tahun 2013, sebuah survei oleh International Federation of Health Plans (IFHP) menemukan bahwa biaya rata-rata etanersept di AS adalah $2.225 per bulan, atau $26.700 per tahun. Laporan IFHP juga menemukan variasi yang luas dalam harga yang dikenakan pada berbagai rencana kesehatan AS, antara $1.946 per bulan pada persentil ke-25 dan $4.006 per bulan pada persentil ke-95.[37]
Etanersept lebih mahal di AS dibandingkan di negara lain. Pada tahun 2013, biaya bulanan rata-rata di negara-negara yang disurvei berkisar antara $1.017 di Swiss hingga $1.646 di Kanada, dibandingkan dengan biaya bulanan rata-rata $2.225 per bulan di AS.[37]
Amgen menjual etanersept di AS dan Kanada; sementara Pfizer, Inc. menjual obat tersebut di luar AS dan Kanada. Penjualan di AS dan Kanada mencapai $3,5 miliar pada tahun 2010.[35] Penjualan etanersept di luar AS dan Kanada mencapai $3,3 miliar pada tahun 2010.[38]
Paten
suntingPaten etanersept akan berakhir pada bulan Oktober 2012,[39] tetapi di Amerika Serikat, paten kedua yang memberikan eksklusivitas selama 16 tahun lagi, telah diberikan.[40]
Sebelum perpanjangan, tampaknya tidak mungkin obat generik akan tersedia. Sebagai obat biologis, etanersept tunduk pada hukum yang berbeda dari yang berlaku untuk formulasi kimia. Banyak negara tidak mengizinkan pembuatan biologika generik. Akan tetapi, Uni Eropa dan Amerika Serikat (Biologics Price Competition and Innovation Act of 2009) memiliki sistem untuk menyetujui biologika generik (biosimilar) yang "memerlukan pengujian klinis wajib dan tinjauan berkala".[41]
Pada bulan April 2013, perusahaan farmasi besar asal India, Cipla, mengumumkan peluncuran biosimilar pertama Etanersept di India dengan nama merek Etacept untuk pengobatan gangguan rematik.[42]
Biosimilar
suntingPada bulan Januari 2016, Benepali disetujui untuk digunakan di Uni Eropa.[43]
Pada bulan Februari 2017, Lifmior disetujui untuk digunakan di Uni Eropa.[44] Obat ini ditarik dari pasaran pada bulan Februari 2020.[45]
Pada bulan Juni 2017, Erelzi disetujui untuk digunakan di Uni Eropa.[46]
Pada bulan Maret 2019, YLB113 (Biosimilar etanersept oleh YL Biologics) disetujui di Jepang.[47]
Pada bulan April 2019, Eticovo menerima persetujuan FDA.[48][49]
Pada bulan Mei 2020, Nepexto disetujui untuk digunakan di Uni Eropa.[50]
Rymti dan Etera disetujui untuk penggunaan medis di Australia pada bulan Oktober 2020.[51][52][53][54]
Referensi
sunting- ^ Feldmann M, Maini RN (October 2003). "Lasker Clinical Medical Research Award. TNF defined as a therapeutic target for rheumatoid arthritis and other autoimmune diseases". Nature Medicine. 9 (10): 1245–1250. doi:10.1038/nm939. PMID 14520364.
- ^ "Drugs@FDA: FDA-Approved Drugs".
- ^ Peppel K, Crawford D, Beutler B (December 1991). "A tumor necrosis factor (TNF) receptor-IgG heavy chain chimeric protein as a bivalent antagonist of TNF activity". The Journal of Experimental Medicine. 174 (6): 1483–1489. doi:10.1084/jem.174.6.1483. PMC 2119031 . PMID 1660525.
- ^ Peppel K, Poltorak A, Melhado I, Jirik F, Beutler B (November 1993). "Expression of a TNF inhibitor in transgenic mice". Journal of Immunology. 151 (10): 5699–5703. doi:10.4049/jimmunol.151.10.5699. PMID 7693816.
- ^ U.S. Patent number: 5,447,851
- ^ "Arthritis Drug Effective for Depression in Psoriasis Sufferers". Diarsipkan dari versi asli tanggal 20 October 2007. Diakses tanggal 10 January 2008.
- ^ Braun J, McHugh N, Singh A, Wajdula JS, Sato R (June 2007). "Improvement in patient-reported outcomes for patients with ankylosing spondylitis treated with etanercept 50 mg once-weekly and 25 mg twice-weekly". Rheumatology. 46 (6): 999–1004. doi:10.1093/rheumatology/kem069 . PMID 17389658.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Norman P (January 2017). "Enbrel and etanercept biosimilars: a tale of two patent systems". Pharmaceutical Patent Analyst. 6 (1): 5–7. doi:10.4155/ppa-2016-0043. PMID 28201948.
- ^ Gardner J (1 November 2021). "A three-decade monopoly: How Amgen built a patent thicket around its top-selling drug".
- ^ Kowalczyk L (24 March 2002). "Lucrative Licensing Deals With Drug, Biotech Firms Are Raising Ethics Issues For Hospitals".
- ^ a b c d e f g "Enbrel- etanercept solution Enbrel- etanercept kit". DailyMed. Diakses tanggal 17 April 2021.
- ^ "Etanercept Product Approval Information - Licensing Action 12/2/98". U.S. Food and Drug Administration (FDA). 1 April 2016. Diarsipkan dari versi asli tanggal 18 January 2017. Diakses tanggal 4 June 2020.
- ^ a b c d e f g h i j k "Enbrel EPAR". European Medicines Agency (EMA). Diakses tanggal 2 April 2020. Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ Siegel YP (2 November 1998). "Approval of Etanercept for treatment of rheumatoid arthritis" (PDF). Surat untuk Sally Gould. U.S. Food and Drug Administration (FDA). Diakses tanggal 14 April 2015.
- ^ Weiss KD (27 May 1999). "Approval of Etanercept for treatment of polyarticular course juvenile rheumatoid arthritis (JRA)" (PDF). Surat untuk Sally Gould. U.S. Food and Drug Administration (FDA). Diakses tanggal 14 April 2015.
- ^ Weiss KD (15 January 2002). "Approval of Etanercept for treatment of psoriatic arthritis". Surat untuk Sally Gould. U.S. Food and Drug Administration (FDA). Diakses tanggal 14 April 2015.
- ^ Keegan P (24 July 2003). "Approval of Etanercept for treatment of ankylosing spondylitis" (PDF). Surat untuk Douglas Hunt. U.S. Food and Drug Administration (FDA). Diakses tanggal 14 April 2015.
- ^ Maxwell LJ, Zochling J, Boonen A, Singh JA, Veras MM, Tanjong Ghogomu E, et al. (April 2015). "TNF-alpha inhibitors for ankylosing spondylitis". The Cochrane Database of Systematic Reviews. 2015 (4): CD005468. doi:10.1002/14651858.CD005468.pub2. PMC 11200207 Periksa nilai
|pmc=(bantuan). PMID 25887212. - ^ Walton M (30 April 2004). "Approval of Etanercept for treatment of moderate to severe plaque psoriasis" (PDF). Surat untuk Douglas Hunt. U.S. Food and Drug Administration (FDA). Diakses tanggal 14 April 2015.
- ^ "New hope for survivors of stroke and traumatic brain injury". Springer Select. 31 October 2012. Diakses tanggal 17 November 2018.
- ^ US 8900583, Tobinick EL, "Methods for treatment of brain injury utilizing biologics", diterbitkan tanggal 2014-12-02
- ^ "Another Free Speech Win In Libel Lawsuit Disguised As A Trademark Complaint". Above the Law (dalam bahasa Inggris). 24 February 2017. Diakses tanggal 27 June 2022.
- ^ "Practice Advisory: Etanercept for Poststroke Disability" (pdf). American Academy of Neurology. 6 June 2016.
- ^ "Wyeth and Amgen heighten warning of life-threatening infections on skin drug Enbrel". Diarsipkan dari versi asli tanggal 5 May 2008. Diakses tanggal 2 May 2008.
- ^ Safety Update on TNF- α Antagonists: Infliximab and Etanercept (PDF). U.S. Food and Drug Administration (FDA). hlm. 13–14. Diarsipkan dari versi asli (PDF) tanggal 24 September 2015. Diakses tanggal 20 December 2013.
- ^ Kim PJ, Lansang RP, Vender R (July 2023). "A Systematic Review and Meta-Analysis of Injection Site Reactions in Randomized-Controlled Trials of Biologic Injections". Journal of Cutaneous Medicine and Surgery. 27 (4): 358–367. doi:10.1177/12034754231188444. PMC 10486173 Periksa nilai
|pmc=(bantuan). PMID 37533141 Periksa nilai|pmid=(bantuan). - ^ Zalevsky J, Secher T, Ezhevsky SA, Janot L, Steed PM, O'Brien C, et al. (August 2007). "Dominant-negative inhibitors of soluble TNF attenuate experimental arthritis without suppressing innate immunity to infection". Journal of Immunology. 179 (3): 1872–1883. doi:10.4049/jimmunol.179.3.1872 . PMID 17641054.
- ^ Madhusudan S, Muthuramalingam SR, Braybrooke JP, Wilner S, Kaur K, Han C, et al. (September 2005). "Study of etanercept, a tumor necrosis factor-alpha inhibitor, in recurrent ovarian cancer". Journal of Clinical Oncology. 23 (25): 5950–5959. doi:10.1200/JCO.2005.04.127. PMID 16135466.
- ^ a b Smola MG, Soyer HP, Scharnagl E (October 1991). "Surgical treatment of dermatofibrosarcoma protuberans. A retrospective study of 20 cases with review of literature". European Journal of Surgical Oncology. 17 (5): 447–453. PMID 1936291.
- ^ Houel S, Hilliard M, Yu YQ, McLoughlin N, Martin SM, Rudd PM, et al. (January 2014). "N- and O-glycosylation analysis of etanercept using liquid chromatography and quadrupole time-of-flight mass spectrometry equipped with electron-transfer dissociation functionality". Analytical Chemistry. 86 (1): 576–584. doi:10.1021/ac402726h. PMID 24308717.
- ^ Mukai Y, Nakamura T, Yoshikawa M, Yoshioka Y, Tsunoda S, Nakagawa S, et al. (November 2010). "Solution of the structure of the TNF-TNFR2 complex". Science Signaling. 3 (148): ra83. doi:10.1126/scisignal.2000954. PMID 21081755.
- ^ Lamanna WC, Mayer RE, Rupprechter A, Fuchs M, Higel F, Fritsch C, et al. (June 2017). "The structure-function relationship of disulfide bonds in etanercept". Scientific Reports. 7 (1): 3951. Bibcode:2017NatSR...7.3951L. doi:10.1038/s41598-017-04320-5. PMC 5479810 . PMID 28638112.
- ^ "What's behind the whopping price tags on the newest generation of drugs: The story behind the production of Enbrel, Amgen's popular rheumatoid arthritis drug, provides insights as to why bioengineered drugs are so expensive." Carol M. Ostrom, Seattle Times, 18 August 2008
- ^ a b Pollock A (23 November 2011). "Amgen's New Enbrel Patent May Undercut Health Care Plan". The New York Times. Diakses tanggal 10 March 2023.
- ^ "Co-pay hike a painful reality; Miracle drug monthly cost jumps from $42 to $600" Diarsipkan 18 January 2013 di Archive.is, Margery Eagan, Boston Herald, 3 November 2011
- ^ a b "2013 Comparative Price Report" (PDF). International Federation of Health Plans. Diarsipkan dari versi asli (PDF) tanggal 22 October 2017. Diakses tanggal 24 November 2017.
- ^ "Portions of the 2010 Financial Report". Sec.gov. Diakses tanggal 5 June 2019.
- ^ "Patent Terms Extended Under 35 USC §156". Diarsipkan dari versi asli tanggal 24 February 2010. Diakses tanggal 9 December 2009.
- ^ "New Amgen Enbrel patent could block biosimilars until 2028". 25 November 2011. Diakses tanggal 14 July 2019.
- ^ Kaldre I (2008). "The Future of Generic Biologics: Should the United States "Follow-On" the European Pathway?". www.law.duke.edu. Diakses tanggal 5 June 2019.
- ^ "Cipla - Home" (PDF). Cipla.com. Diarsipkan dari versi asli (PDF) tanggal 1 May 2013. Diakses tanggal 5 June 2019.
- ^ "Benepali EPAR". European Medicines Agency (EMA). Diakses tanggal 2 April 2020.
- ^ "Lifmior EPAR". European Medicines Agency (EMA). Diakses tanggal 2 April 2020.
- ^ "Public statement on Lifmior: Withdrawal of the marketing authorisation in the European Union" (PDF). Diakses tanggal 2 April 2020.
- ^ "Erelzi EPAR". European Medicines Agency (EMA). Diakses tanggal 2 April 2020.
- ^ "Japanese approval for Lupin's etanercept biosimilar".
- ^ "Drug Approval Package: Eticovo". U.S. Food and Drug Administration (FDA). 18 June 2019. Diakses tanggal 26 September 2024.
- ^ "FDA approves etanercept biosimilar Eticovo". www.gabionline.net. Diakses tanggal 16 July 2024.
- ^ "Nepexto EPAR". European Medicines Agency. 24 March 2020. Diakses tanggal 4 March 2023.
- ^ "Australian Public Assessment Report for Etanercept" (PDF). Feb 2021.
- ^ "AusPAR: Etanercept". Therapeutic Goods Administration (TGA). 25 February 2021. Diakses tanggal 12 June 2021.
- ^ "Rymti ARTG". Therapeutic Goods Administration (TGA). Diarsipkan dari versi asli tanggal 13 June 2021. Diakses tanggal 12 June 2021.
- ^ "Etera ARTG". Therapeutic Goods Administration (TGA). Diarsipkan dari versi asli tanggal 13 June 2021. Diakses tanggal 12 June 2021.