Kalium heksakloroplatinat
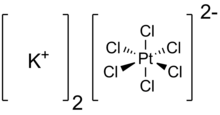
Kalium heksakloroplatinat adalah senyawa anorganik dengan rumus kimia K2PtCl6. Ini adalah padatan kuning yang merupakan contoh garam kalium yang relatif tidak larut. Garam ini memiliki dianion heksakloroplatinat yang termasuk geometri koordinasi oktahedral.
| |

| |
| Penanda | |
|---|---|
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| K2PtCl6 | |
| Massa molar | 485.99 g/mol |
| Penampilan | padatan jingga kekuningan |
| Densitas | 3.344 g/cm3 |
| Titik lebur | 250 °C (482 °F; 523 K) (terurai) |
| 0.89 g/100ml H2O (pada 25 °C) [1] | |
| Bahaya | |
| Lembar data keselamatan | Oxford MSDS |
Klasifikasi UE (DSD) (usang)
|
Toksik (T) |
| Titik nyala | 250 °C (482 °F; 523 K) |
| Senyawa terkait | |
Anion lain
|
Kalium tetrakloroplatinat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Pengendapan senyawa ini dari larutan asam heksakloroplatinat sebelumnya digunakan untuk penentuan kalium dengan analisis gravimetri.[2] Ini juga berguna sebagai perantara dalam pemulihan platinum dari limbah.[3]
Reaksi
suntingMenggunakan reaksi metatesis garam, kalium heksakloroplatinat dikonversi menjadi berbagai amonium kuaterner dan garam lipofilik terkait. Ini termasuk garam tetrabutylammonium (NBu4).2PtCl6, yang dikenal sebagai katalis Lukevics.[4]
Pengurangan kalium heksakloroplatinat dengan hidrazin dihidroklorida menghasilkan garam tetrakloroplatinat yang sesuai.[5][6]
Referensi
sunting- ^ Grinberg, A. A.; Sibirskaya, V. V. (1967). "Solubility of hexammine and hexahalo platinum(IV) complexes". Zhurnal Neorganicheskoi Khimii. 12: 2069–2071.
- ^ G. F. Smith; J. L. Gring (1933). "The Separation and Determination of the Alkali Metals Using Perchloric Acid. V. Perchloric Acid and Chloroplatinic Acid in the Determination of Small Amounts of Potassium in the Presence of Large Amounts of Sodium". J. Am. Chem. Soc. 55 (10): 3957–3961. doi:10.1021/ja01337a007.
- ^ George B. Kauffman, Larry A. Teter "Recovery of Platinum from Laboratory Residues" Inorganic Syntheses, 1963, volume 7, pp. 232-236. doi:10.1002/9780470132388.ch61
- ^ Iovel, I. G.; Goldberg, Y. S.; Shymanska, M. V.; Lukevics, E. (1987). "Quaternary Onium Hexachloroplatinates: Novel Hydrosilylation Catalysts". Organometallics. 6: 1410–1413. doi:10.1021/om00150a007.
- ^ George B. Kauffman, Dwaine A. Cowan (1963). "cis- and trans-Dichlorodiammine Platinum(II)". Inorganic Syntheses. 7: 239. doi:10.1002/9780470132388.ch63.
- ^ Keller, R. N.; Moeller, T. (1963). "Potassium Tetrachloroplatinate(II)". Inorg. Synth. 7: 247–250. doi:10.1002/9780470132333.ch79.