Sofosbuvir
Sofosbuvir, dijual di pasar di antaranya sebagai sovaldi, adalah obat yang digunakan untuk pengobatan hepatitis C.[2] Hanya dianjurkan dengan beberapa kombinasi ribavirin, peginterferon-alfa, simeprevir, ledipasvir, atau daclatasvir. Tingkat kesembuhan 30 sampai 97%, bergantung pada jenis virus hepatitis C yang terlibat. Keamanan selama kehamilan tidak jelas; sementara, beberapa obat yang digunakan dalam kombinasi dapat mengakibatkan bahaya untuk bayi.[3] Dikonsumsi secara oral.
| |
|---|---|
| Nama sistematis (IUPAC) | |
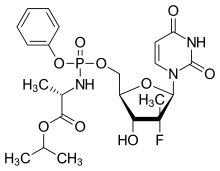
| Isopropil (2S)-2-[[[(2R,3R,4R,5R)-5-(2,4-dioksopirimidin-1-yl)-4-fluoro-3-hidroksi-4-metil-tetrahidrofuran-2-yl]metoksi-fenoksi-fosforil]amino]propanoat | |
| Data klinis | |
| Nama dagang | Sovaldi, Soforal, dll.[1] |
| AHFS/Drugs.com | monograph |
| Data lisensi | US FDA:link |
| Kat. kehamilan | B(US) |
| Status hukum | ℞-only (US) |
| Rute | oral[2] |
| Data farmakokinetik | |
| Bioavailabilitas | 92% |
| Ikatan protein | 61–65% |
| Metabolisme | Secara cepat teraktivasi oleh trifosfat (CatA/CES1, HIST1, fosforilasi) |
| Waktu paruh | 0.4 jam (sofosbuvir) 27 jam (metabolit tidak aktif GS-331007) |
| Ekskresi | 80% urin, 14% feses (kebanyakan sebagai GS-331007) |
| Pengenal | |
| Nomor CAS | 1190307-88-0 |
| Kode ATC | J05AX15 |
| PubChem | CID 45375808 |
| Ligan IUPHAR | 7368 |
| DrugBank | DB08934 |
| ChemSpider | 26286922 |
| UNII | WJ6CA3ZU8B |
| KEGG | D10366 |
| ChEBI | CHEBI:85083 |
| ChEMBL | CHEMBL1259059 |
| Sinonim | PSI-7977; GS-7977 |
| Data kimia | |
| Rumus | C22H29FN3O9P |
| Massa mol. | 529.453 g/mol |
| SMILES | eMolecules & PubChem |
| |
Artikel ini memberikan informasi dasar tentang topik kesehatan. |
Efek samping yang umum meliputi rasa lelah, sakit kepala, mual, dan kesulitan tidur. Efek samping secara umum lebih sering terjadi pada rejimen yang mengandung interferon.[4]:7 Sofosbuvir dapat mengaktifkan kembali virus hepatitis B pada mereka yang telah terinfeksi sebelumnya.[5] Dalam kombinasi dengan ledipasvir, daclatasvir atau simeprevir, obat ini tidak dianjurkan dengan amiodarone karena risiko akan detak jantung lambat yang tidak normal. Sofosbuvir termasuk dalam keluarga obat analog nukleotida dan bekerja dengan mengeblok protein NS5B hepatitis C.[6]
Sofosbuvir ditemukan pada tahun 2007 dan disetujui untuk penggunaan medis di Amerika Serikat pada tahun 2013.[7][8] Obat ini ada dalam Daftar Obat Esensial Organisasi Kesehatan Dunia, obat-obatan paling efektif dan aman yang dibutuhkan dalam sistem kesehatan.[9] Pada tahun 2016, pengobatan dua belas pekan memakan biaya sekitar $84.000 di Amerika Serikat, $53.000 di Inggris Raya, $45.000 di Kanada, dan $483 di India.[10] Lebih dari 60.000 orang telah diobati dengan sofosbuvir dalam tiga puluh minggu pertama penjualannya di Amerika Serikat.[11]
Penggunaan medis
suntingPengobatan HCV awal
suntingSofosbuvir digunakan untuk pengobatan hepatitis C kronis, genotip 1, 2, 3, 4, 5, dan 6, biasanya dalam kombinasi dengan obat lain bergantung pada genotip tertentu. Untuk pengobatan infeksi hepatitis C genotip 1, 4, 5, dan 6, sofosbuvir digunakan dalam kombinasi dengan inhibitor virus NS5A ledipasvir. Untuk pengobatan genotip lain, sofosbuvir digunakan dalam kombinasi dengan ribavirin berbasis berat sendiri dalam infeksi HCV genotip 2, dan bersama peginterferon dalam infeksi HCV genotip 3.[12]
Dibandingkan dengan pengobatan sebelumnya, rejimen berbasis sofosbuvir memberikan tingkat kesembuhan yang lebih tinggi, efek samping yang lebih sedikit, dan durasi terapi yang berkurang dua sampai empat kali lipat.[13][14][15] Sofosbuvir memungkinkan kebanyakan orang untuk dapat berhasil diobati tanpa menggunakan peginterferon, obat injeksi dengan efek samping parah yang merupakan komponen kunci kombinasi obat yang lebih tua untuk pengobatan hepatitis C.[16][17]
Pada tahun 2016, Asosiasi Amerika untuk Studi Penyakit Hati dan Komunitas Penyakit Menular Amerika bersama-sama menerbitkan rekomendasi pengendalian hepatitis C. Dalam rekomendasi ini, sofosbuvir dan ledipasvir, atau sofosbuvir dan ribavirin dengan atau tanpa peginterferon, adalah bagian dari semua pengobatan lini pertama infeksi HCV genotip 1 sampai 6, dan juga bagian dari beberapa lini kedua pengobatan.
Pengobatan yang gagal sebelumnya
suntingUntuk orang yang mengalami kegagalan pengobatan dengan beberapa bentuk terapi kombinasi untuk infeksi hepatitis C, salah satu langkah selanjutnya yang mungkin adalah pengobatan kembali dengan sofosbuvir dan ledipasvir, dengan atau tanpa ribavirin berdasarkan berat badan. Terapi kombinasi khusus seseorang pada saat pengobatan awal gagal juga menjadi bahan pertimbangan ketika memutuskan kombinasi mana untuk penggunaan berikutnya. Durasi terapi juga dapat berkisar dari 12 pekan sampai 24 pekan, bergantung pada faktor seperti obat yang digunakan untuk terapi, apakah orang tersebut memiliki hati sirosis atau tidak, dan apakah kerusakan hati diklasifikasikan sebagai sirosis kompensasi atau sirosis terdekompensasi.
Kehamilan dan menyusui
suntingSofosbuvir sendiri ditetapkan sebagai Kehamilan Kategori B oleh FDA (berarti bahwa tidak ada studi memadai dan terkontrol baik pada wanita hamil, tetapi studi reproduksi hewan tidak menunjukkan risiko pada janin dan, atau efek buruk tampak pada studi hewan, tetapi studi memadai dan terkontrol baik pada wanita hamil tidak, di trimester manapun). Namun, ribavirin, obat yang sering diberikan bersama sofosbuvir untuk mengobati hepatitis C, ditetapkan sebagai Kehamilan Kategori X (kontraindikasi pada kehamilan) oleh FDA. Ibu hamil dengan hepatitis C yang mengonsumsi ribavirin telah menunjukkan beberapa kasus cacat lahir dan kematian pada janin mereka.[18] Terdapat rekomendasi bahwa kombinasi sofosbuvir/ribarivin dihindari oleh wanita hamil dan mitra seksual laki-lakinya dalam rangka mengurangi kecacatan janin berbahaya yang disebabkan oleh ribavirin. Perempuan yang berpotensi hamil harus menjalani tes kehamilan 2 bulan sebelum memulai pengobatan kombinasi sofosbuvir/ribavirin/peginterferon, bulanan sepanjang durasi pengobatan, dan 6 bulan pascapengobatan untuk mengurangi risiko membahayakan janin dalam kasus kehamilan tak terduga.
Tidak diketahui apakah sofosbuvir dan ribavirin masuk ke asi; oleh karena itu, dianjurkan ibu tidak menyusui selama pengobatan dengan sofosbuvir sendiri atau dalam kombinasi dengan ribavirin.
Kontraindikasi
suntingTidak ada kontraindikasi spesifik untuk sofosbuvir ketika digunakan sendiri. Namun, bila digunakan dalam kombinasi dengan ribavirin atau peginterferon alfa/ribavirin, kontraindikasi berlaku untuk agen ini diterapkan.Karena ribavirin dapat menyebabkan cacat lahir dan kematian janin, Sofosbuvir dalam kombinasi dengan peginterferon alfa / ribavirin atau ribavirin merupakan kontraindikasi pada wanita hamil dan pada pria yang pasangan wanitanya hamil.
Efek samping
suntingSofosbuvir yang digunakan sendirian dan dalam kombinasi dengan obat lain seperti ribavirin dengan atau tanpa peginterferon memiliki profil keamanan yang baik. Efek samping yang umum adalah kelelahan, sakit kepala, mual, ruam, lekas marah, pusing, nyeri punggung, dan anemia. Sebagian besar efek samping secara signifikan lebih umum untuk rejimen yang mengandung interferon dibandingkan dengan yang bebas interferon. Misalnya, kelelahan dan sakit kepala hampir terpotong setengah, gejala seperti influenza berkurang menjadi 3-6% dibandingkan dengan 16-18%, dan neutropenia hampir tidak ada pada pengobatan bebas interferon.:7[19]
Sofosbuvir dapat mengaktifkan kembali virus hepatitis B pada mereka yang telah terinfeksi sebelumnya.
Interaksi
suntingSofosbuvir (dalam kombinasi dengan ledipasvir, daclatasvir atau simeprevir) tidak boleh digunakan dengan amiodarone karena risiko dari detak jantung lambat yang abnormal.
Sofosbuvir adalah substrat dari P-glikoprotein, protein transporter yang memompa obat-obatan dan zat-zat lain dari sel epitel usus kembali ke usus. Oleh karena itu, induser P-glikoprotein usus, seperti rifampisin dan wort St John, bisa mengurangi penyerapan sofosbuvir.
Selain itu, pemberian bersamaan sofosbuvir dengan antikonvulsan (karbamazepin, fenitoin, fenobarbital, oxcarbazepine), antimikobakterial (rifampisin, rifabutin, rifapentine), dan inhibitor protease HIV tipranavir dan ritonavir diyakini mengurangi konsentrasi sofosbuvir. Dengan demikian, pemberian bersamaan tidak dianjurkan.
Interaksi antara sofosbuvir dan sejumlah obat lain, seperti siklosporin, darunavir/ritonavir, efavirenz, emtricitabine, metadon, raltegravir, rilpivirine, tacrolimus, atau tenofovir disoproxil, dievaluasi dalam uji klinis dan tidak ada penyesuaian dosis yang diperlukan untuk setiap obat ini.[20]
Farmakologi
suntingMekanisme aksi
suntingSofosbuvir menghambat protein NS5B virus hepatitis C. Sofosbuvir tampak memiliki penghalang yang tinggi untuk pengembangan resistansi.[21]
Sofosbuvir adalah prodrug. Ia dimetabolisme menjadi agen antivirus aktif GS-461203 (2'-deoksi-2'-α-fluoro-β-C-metiluridin-5'-trifosfat). GS-461203 berfungsi sebagai substrat defektif protein NS5B, polimerase virus RNA, sehingga bertindak sebagai inhibitor sintesis viral RNA.[22] Meskipun sofosbuvir memiliki gugus 3' hidroksil yang bertindak sebagai nukleofil untuk NTP yang masuk, nukleotida analog yang mirip, 2'-deoksi-2'-α-fluoro-β-C-metilcitidin, diajukan agar bertindak sebagai rantai terminator karena gugus 2' metil dari analog nukleotidanya menyebabkan bentrokan sterik dengan NTP yang masuk.[23] Sobosbuvir akan bertindak dalam cara yang sama.
Farmakokinetik
suntingSofosbuvir hanya diberikan secara oral. Konsentrasi puncak setelah pemberian oral 0,5–2 jam pasca pemberian, terlepas dari dosis awal.[24] Puncak konsentrasi plasma metabolit GS-331077 utama yang beredar terjadi 2-4 jam pasca pemberian. GS-331077 adalah nukleosida yang secara farmakologi tidak aktif.
Ikatan protein plasma dari sofosbuvir adalah 61-65%, sementara GS-331077 memiliki ikatan minimal.
Sofosbuvir diaktifkan dalam hati menjadi trifosfat GS-461203 melalui hidrolisis dari ester karboksilat oleh enzim cathepsin A atau carboksilesterase 1, diikuti dengan pembelahan phosphoramidat oleh enzim histidin triad nucleotide-binding protein 1 (HINT1), dan fosforilasi berulang selanjutnya.[25] Defosforilasi menghasilkan metabolit tidak aktif GS-331077. Paruh waktu sofosbuvir adalah 0,4 jam, sedangkan GS-331007 27 jam.
Setelah satu dosis oral 400 mg sofosbuvir, 80% diekskresikan dalam urin, 14% dalam tinja, dan 2,5% dalam pengambilan kembali udara kedaluwarsa. Namun, dari urin yang diperoleh: 78% adalah metabolit (GS-331007) dan 3,5% sofosbuvir.
Kimia
suntingSebelum penemuan sofosbuvir, berbagai analog nukleosida telah diuji coba sebagai pengobatan antihepatitis C, tetapi mereka menunjukkan potensi yang relatif rendah. Potensi yang rendah ini muncul sebagian karena adisi enzimatik pertama dari tiga gugus fosfat dari atp lambat. Desain sofosbuvir, berdasarkan pendekatan ProTide, menghindari langkah lambat ini dengan membangun gugus fosfat pertama ke struktur obat selama sintesis. Gugus tambahan melekat pada fosfor untuk menutupi sementara dua muatan negatif dari gugus fosfat sehingga memudahkan masuknya obat ke dalam sel yang terinfeksi.[26] Protein NS5B adalah RNA polimerase dependen-RNA penting untuk siklus reproduksi virus.
Sejarah
suntingSofosbuvir ditemukan oleh Michael Sofia, seorang ilmuwan di Pharmasset, pada tahun 2007 dan obat itu pertama kali diuji pada manusia pada tahun 2010 dan pada tahun 2011 Gilead membeli Pharmasset sekitar $11 miliar. Gilead menyampaikan Aplikasi Obat Baru sofosbuvir dalam kombinasi dengan ribavirin pada April 2013, dan pada Oktober 2013 menerima Gelar Terapi Terobosan FDA.[27] Pada Desember 2013, FDA menyetujui sofosbuvir dalam kombinasi dengan ribavirin untuk terapi dual oral infeksi HCV genotip 2 dan 3, dan untuk terapi tripel dengan suntikan pegylated interferon (pegIFN) dan RBV untuk orang-orang belum terobati dengan infeksi HCV genotip 1 dan 4.[28][29] Dua bulan sebelumnya, FDA telah menyetujui obat lain untuk HepC, simeprevir.
Pada tahun 2014, obat kombinasi berdosis tetap sofosbuvir/ledipasvir, yang terakhir adalah inhibitor NS5A virus, disetujui; juga diberikan gelar terobosan.[30]
Sebelum ketersediaan sofosbuvir, pengobatan hepatitis C melibatkan pengobatan 6 sampai 12 bulan dengan rejimen berbasis interferon yang memberikan tingkat kesembuhan 70% atau kurang; dikaitkan dengan efek samping yang parah seperti anemia, depresi, ruam, mual, diare, dan kelelahan. Seiring pengembangan klinis sofosbuvir berlajut, dokter mulai "menggudangkan" orang-orang dalam mengantisipasi ketersediaan obat tsb.[31] Peluncuran sofosbuvir AS adalah yang tercepat dari obat baru manapun dalam sejarah.[32] Lebih dari 60.000 orang diobati dengan sofosbuvir di 30 minggu pertama pasar AS, sekitar 5% dari penduduk AS yang terinfeksi.
Masyarakat dan budaya
suntingSofosbuvir ada dalam Daftar Obat-obatan Esensial Organisasi Kesehatan Dunia, obat-obatan paling penting yang diperlukan dalam sistem kesehatan dasar.[33]
Harga sofosbuvir, dikutip dari berbagai sumber media adalah $ 84.000 sampai $ 168.000 untuk pengobatan di AS,[34] £ 35.000 di Inggris untuk 12 pekan[35] telah menimbulkan kontroversi. Namun, sofosbuvir secara signifikan lebih terjangkau di Jepang dan Korea Selatan dengan kisaran masing-masing $300 dan $5900 untuk pengobatan 12 minggu, dengan masing-masing pemerintah membantu 99% dan 70% biaya masing-masing. Pada tahun 2014, Gilead mengumumkan bahwa mereka akan bekerja dengan produsen manufaktur generik di 91 negara berkembang untuk memproduksi dan menjual sofosbuvir, dan bahwa mereka akan menjual versi nama merek produk di India untuk sekitar $300 per pengobatan; mereka pun menandatangani perjanjian dengan produsen-produsen manufaktur generik pada September 2015.[36][37]
Biaya
suntingHarga telah menimbulkan kontroversi.[38][39]
Amerika Serikat
suntingPada 2016 satu pengobatan menghabiskan sekitar $ 84.000 di Amerika Serikat. Pada tahun 2014, daftar harga pengobatan kombinasi 12 pekan dengan rejimen sofosbuvir berbasis sosbuvir berkisar dari $ 84.000 sampai $ 94.000.[40][41][42] Pada bulan April 2014, House Demokrat AS: Henry Waxman, Frank Pallone Jr., dan Diana DeGette menulis kepada Gilead Sciences Inc. mempertanyakan harga $ 84.000 sofosbuvir. Mereka secara spesifik meminta CEO Gilead John Martin untuk "menjelaskan bagaimana obat itu diberi harga, diskon apa yang sedang dibuat tersedia untuk pasien berpenghasilan rendah dan program kesehatan pemerintah, dan dampak potensial terhadap kesehatan masyarakat oleh perusahaan asuransi yang menghalangi atau menunda akses ke obat ini karena biayanya."[43] Sofosbuvir dikutip sebagai contoh dari bagaimana obat khusus menghadirkan baik manfaat maupun tantangan.[44][45]
Pada Februari 2015, Gilead mengumumkan bahwa sebagian karena diskon yang dinegosiasikan dengan para pengelola keuntungan farmasi dan diskon yang secara sah dimandatkan untuk pembayar pemerintah, diskon rata-rata untuk harga pada daftar pada 2014 adalah 22%. Perusahaan ini memperkirakan bahwa diskon rata-rata pada 2015 akan menjadi 46%.[46] Menurut California Technology Assessment Forum, dewan yang terdiri atas pakar farmakoekonomik akademik, para perwakilan organisasi perawatan termanajemen, dan para advokat orang-orang dengan hepatitis, diskon 46% akan membuat harga rata-rata pengobatan menjadi sekitar $ 40.000, harga yang di mana rejimen pengobatan berbasis sofosbuvir menunjukkan "harga tinggi" untuk masyarakat dan sistem-sistem perawatan kesehatan.[47][48][49]
Jerman
suntingDi Jerman, negosiasi antara Gilead dan asuransi kesehatan berujung pada harga € 41.000 untuk pengobatan 12 pekan, yaitu harga yang sama yang sebelumnya dinegosiasikan dengan sistem kesehatan nasional di Prancis kecuali bahwa tambahan diskon dan rabat berlaku di Prancis bergantung pada volume penjualan dan jumlah kegagalan pengobatan.[50]
Swiss
suntingDi Swiss, harga ditetapkan oleh negara setiap tiga tahun. Harga CHF 16.102,50 untuk 24 pil 400 mg.[51]
Inggris Raya
suntingHarga di Inggris Raya ini diduga £ 35.000 (~$ 68.110 AS) untuk 12 pekan. NHS England telah mendirikan 22 Jaringan Pengiriman Operasional untuk menggelar pengiriman yang telah disetujui oleh Institut Nasional untuk Keunggulan Kesehatan dan Perawatan pada tahun 2015, dan melakukan proposal untuk mendanai 10.000 program pengobatan pada tahun 2016-17. Masing-masing telah diberi "run rate" akan berapa banyak orang yang mereka diizinkan untuk obati, yang merupakan investasi pengobatan baru terbesar tunggal NHS pada tahun 2016.[52]
Asia
suntingTidak seperti negara-negara Barat, sofosbuvir lebih terjangkau di Jepang dan Korea Selatan, sekitar $300 dan $5900 masing-masing selama pengobatan 12 pekan, dengan masing-masing pemerintah menutupi 99% dan 70% biaya masing-masing.[53][54]
Negara berkembang
suntingPada tahun 2014, Gilead mengumumkan bahwa mereka akan mencari perjanjian lisensi generik dengan produsen manufaktur untuk memproduksi sofosbuvir di 91 negara berkembang, mengandung 54% dari penduduk dunia yang terinfeksi HCV dan bahwa mereka akan menjual versi nama merek dari produk di India untuk $300 per pengobatan, sekitar dua kali lipat dari estimasi minimum pihak ketiga akan biaya pembuatan yang mungkin dicapai. Mereka telah menandatangani kontrak lisensi dengan produsen manufaktur generik pada bulan September 2015. Pemimpin salah satu kelompok aktivis India menyebut gerakan ini tidak cukup, tetapi sembilan perusahaan meluncurkan produk, "melepaskan perang pemasaran sengit" menurut The Economic Times India.[1]
Jennifer Cohn dari Dokter tanpa Perbatasan dan organisasi Dokter Dunia mengkritik harga sofosbuvir mencerminkan "keserakahan korporasi" dan mengabaikan kebutuhan orang-orang di negara berkembang. Sebaliknya, Indeks Akses ke Obat-Obatan memeringkat Gilead sebagai yang pertama di dunia dari 20 farmasi terbesar berbagai negara dalam kategori Harga, Manufaktur, dan Distribusi baik pada 2013 maupun 2014, mengutip Gilead: "kinerja terkemuka dalam harga yang adil".[55]
Di Aljazair, pada tahun 2011 sekitar 70.000 orang terinfeksi hepatitis C.[56] Pada Agustus 2015, Gilead memberikan lisensi kepada mitra-mitranya di India untuk menjual sofosbuvir di Aljazair.[57][58] Telah dikritik tidak membuat obat ini tersedia di negara-negara berpenghasilan menengah seperti Aljazair sebelum itu.[59]
Tantangan paten
suntingDi bulan Januari 2015, Kantor Paten India di Mumbai menolak aplikasi paten Gilead.[60] Keputusan itu dibatalkan pada tingkat banding pada bulan Februari 2015.[61][62]
Pada bulan Februari 2015 dilaporkan[63] Dokter Dunia telah mengajukan keberatan terhadap paten Gilead[64] kepada Kantor Paten Eropa mengklaim bahwa struktur sofosbuvir berdasar pada molekul yang sudah dikenal.[65] Secara khusus, Dokter Dunia berargumen bahwa teknologi Protide yang memberi kekuatan pada sofosbuvir telah diciptakan sebelumnya oleh tim McGuigan di Cardiff University di Inggris, dan bahwa obat Gilead ini oleh karena itu tidak inventif.[66][67] Kelompok ini mengajukan tantangan di negara-negara berkembang dunia yang lain juga.[68]
Penelitian
suntingKombinasi sofosbuvir dengan inhibitor NS5A, seperti daclatasvir atau ledipasvir, telah menunjukkan sustained virological response rate hingga 100% pada orang yang terinfeksi oleh HCV. Kebanyakan studi menunjukkan bahwa tingkat keberhasilan antara 94% dan 97%; jauh lebih tinggi dari pilihan pengobatan sebelumnya.[69][70]
Lihat juga
sunting- Tenofovir alafenamid—reverse transcriptase inhibitor nukleotida yang menggunakan teknologi prodrug fosforamidat yang mirip[71][72]
Referensi
sunting- ^ a b Divya Rajagopal for the Economic Times.
- ^ a b "Sofosbuvir". The American Society of Health-System Pharmacists. Diakses tanggal Nov 30, 2016.
- ^ "Sovaldi 400 mg film coated tablets - Summary of Product Characteristics (SPC) - (eMC)". www.medicines.org.uk. Diarsipkan dari versi asli tanggal 2016-11-10. Diakses tanggal 8 January 2017.
- ^ "Sofosbuvir label" (PDF). FDA. August 2015.
- ^ "Direct-Acting Antivirals for Hepatitis C: Drug Safety Communication - Risk of Hepatitis B Reactivating". FDA. 4 October 2016. Diakses tanggal 6 October 2016.
- ^ "Sovaldi 400 mg film coated tablets - Summary of Product Characteristics". UK Electronic Medicines Compendium. September 2016. Diarsipkan dari versi asli tanggal 2016-11-10. Diakses tanggal 10 November 2016.
- ^ "Sofosbuvir (Sovaldi) - Treatment - Hepatitis C Online". www.hepatitisc.uw.edu. Diakses tanggal 8 January 2017.
- ^ Gounder, Celine (9 December 2013). "A Better Treatment for Hepatitis C". The New Yorker.
- ^ "WHO Model List of Essential Medicines (19th List)" (PDF). World Health Organization. April 2015. Diakses tanggal 8 December 2016.
- ^ Hill, A; Simmons, B; Gotham, D; Fortunak, J (1 January 2016). "Rapid reductions in prices for generic sofosbuvir and daclatasvir to treat hepatitis C". Journal of virus eradication. 2 (1): 28–31. PMC 4946692 . PMID 27482432.
- ^ Associated Press; Alonso-Zaldivar, Ricardo (July 29, 2014). "Gilead's Sovaldi prescribed more than all other hepatitis C drugs combined – The Mercury News". Mercury News.
- ^ "Recommendations for Testing, Managing, and Treating Hepatitis C" (PDF). AASLD/IDSA. 27 September 2016. Diarsipkan dari versi asli (PDF) tanggal 2016-11-10. Diakses tanggal 10 November 2016.
- ^ Berden FA, Kievit W, Baak LC, et al. (October 2014). "Dutch guidance for the treatment of chronic hepatitis C virus infection in a new therapeutic era". Neth J Med. 72 (8): 388–400. PMID 25387551.
- ^ Cholongitas E, Papatheodoridis GV (2014). "Sofosbuvir: a novel oral agent for chronic hepatitis C". Ann Gastroenterol. 27 (4): 331–337. PMC 4188929 . PMID 25332066.
- ^ Tran TT (December 2012). "A review of standard and newer treatment strategies in hepatitis C". Am J Manag Care. 18 (14 Suppl): S340–9. PMID 23327540.
- ^ Yau AH, Yoshida EM (September 2014). "Hepatitis C drugs: the end of the pegylated interferon era and the emergence of all-oral interferon-free antiviral regimens: a concise review". Can J Gastroenterol Hepatol. 28 (8): 445–51. PMC 4210236 . PMID 25229466.
- ^ Calvaruso V, Mazza M, Almasio PL (May 2011). "Pegylated-interferon-α(2a) in clinical practice: how to manage patients suffering from side effects". Expert Opin Drug Saf. 10 (3): 429–35. doi:10.1517/14740338.2011.559161. PMID 21323500.
- ^ "Copegus (Ribavirin, USP Tablets) Medication Guide" (PDF). Roche. Diakses tanggal 28 October 2014.
- ^ Bhatia, Harmeet Kaur; Singh, Harmanjit; Grewal, Nipunjot; Natt, Navreet Kaur (2014-01-01). "Sofosbuvir: A novel treatment option for chronic hepatitis C infection". Journal of Pharmacology & Pharmacotherapeutics. 5 (4): 278–284. doi:10.4103/0976-500X.142464. ISSN 0976-500X. PMC 4231565 . PMID 25422576.
- ^ Karageorgopoulos, Drosos E.; El-Sherif, Omar; Bhagani, Sanjay; Khoo, Saye H. (February 2014). "Drug interactions between antiretrovirals and new or emerging direct-acting antivirals in HIV/hepatitis C virus coinfection". Current Opinion in Infectious Diseases. 27 (1): 36–45. doi:10.1097/QCO.0000000000000034. PMID 24305043.
- ^ Pol, Stanislas; Vallet-Pichard, Anaïs; Corouge, Marion (March 2016). "Daclatasvir–sofosbuvir combination therapy with or without ribavirin for hepatitis C virus infection: from the clinical trials to real life". Hepatic Medicine: Evidence and Research. 8: 21–6. doi:10.2147/HMER.S62014. PMC 4786064 . PMID 27019602.
- ^ Fung, A; Jin, Z; Dyatkina, N; Wang, G; Beigelman, L; Deval, J (2014). "Efficiency of incorporation and chain termination determines the inhibition potency of 2'-modified nucleotide analogs against hepatitis C virus polymerase". Antimicrobial Agents and Chemotherapy. 58 (7): 3636–45. doi:10.1128/AAC.02666-14. PMC 4068585 . PMID 24733478.
- ^ Ma, H.; Jiang, W.-R.; Robledo, N.; Leveque, V.; Ali, S.; Lara-Jaime, T.; Masjedizadeh, M.; Smith, D. B.; Cammack, N.; Klumpp, K.; Symons, J. (2007). "Characterization of the Metabolic Activation of Hepatitis C Virus Nucleoside Inhibitor β-d-2′-Deoxy-2′-fluoro-2′-C-methylcytidine (PSI-6130) and Identification of a Novel Active 5′-Triphosphate Species". The Journal of Biological Chemistry. 282 (41): 29812–29820. doi:10.1074/jbc.M705274200. PMID 17698842.
- ^ Kirby, Brian J.; Symonds, William T.; Kearney, Brian P.; Mathias, Anita A. (2015-03-31). "Pharmacokinetic, Pharmacodynamic, and Drug-Interaction Profile of the Hepatitis C Virus NS5B Polymerase Inhibitor Sofosbuvir". Clinical Pharmacokinetics (dalam bahasa Inggris). 54 (7): 677–690. doi:10.1007/s40262-015-0261-7. PMID 25822283.
- ^ Dinnendahl, V; Fricke, U, ed. (2015). Arzneistoff-Profile (dalam bahasa German). 9 (edisi ke-28). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
- ^ "Mechanism of activation of PSI-7851 and its diastereoisomer PSI-7977". J. Biol. Chem. 285 (45): 34337–47. November 2010. doi:10.1074/jbc.M110.161802. PMC 2966047 . PMID 20801890.
- ^ "Application Number: 204671Orig1s000: Medical Reviews" (PDF). FDA. November 20, 2013.
- ^ "FDA approves Sovaldi for chronic hepatitis C". FDA New Release. U.S. Food and Drug Administration. 2013-12-06.
- ^ Tucker M (December 6, 2013). "FDA Approves 'Game Changer' Hepatitis C Drug Sofosbuvir". Medscape.
- ^ "FDA approves first combination pill to treat hepatitis C".
- ^ "Hepatitis C Dilemma: Treat Illness With Interferon Now or Wait? - WSJ".
- ^ Herper, Matthew (February 21, 2014). "Gilead's Hepatitis C Pill Takes Off Like A Rocket". Forbes.
- ^ "Essential Medicines WHO Model List, 19th edition, April 2015" (PDF). World Health Organization. 2015.
- ^ Harris, Gardiner (15 September 2014). "Maker of Costly Hepatitis C Drug Sovaldi Strikes Deal on Generics for Poor Countries". The New York Times.
- ^ Boseley, Sarah (15 January 2015). "Hepatitis C drug delayed by NHS due to high cost". The Guardian.
- ^ "Minimum target prices for production of direct acting antivirals and associated diagnostics to combat Hepatitis C Virus". Hepatology. 61 (4): 1174–82. December 2014. doi:10.1002/hep.27641. PMC 4403972 . PMID 25482139.
- ^ Kalra, Aditya; Siddiqui, Zeba (September 15, 2014). "Gilead licenses hepatitis C drug to Cipla, Ranbaxy, five others". Reuters India (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 2014-12-10. Diakses tanggal 2017-06-08. CS1 maint: Unrecognized language (link)
- ^ Stanton, Tracy. "Activists pounce on $1,000-a-day price for Gilead's hep C wonder drug, Sovaldi". FiercePharma. Fierce. Diarsipkan dari versi asli tanggal 2014-02-18. Diakses tanggal 22 February 2014.
- ^ Waldman, Ron. "Gilead's HCV drug sofosbuvir approved by the FDA but accessible for how many?" (PDF). Doctors of the World. Diarsipkan dari versi asli (PDF) tanggal 2014-02-26. Diakses tanggal 22 February 2014.
- ^ Pollack, Andrew (October 10, 2014). "Harvoni, a Hepatitis C Drug from Gilead, Wins F.D.A. Approval". The New York Times.
- ^ Staff (December 11, 2014). "Gilead Faces Lawsuit Over Hepatitis C Drug Pricing". Drug Discovery & Development. United States: Advantage Business Media. Associated Press.
- ^ Pollack, Andrew (December 6, 2013). "F. D. A. Approves Pill to Treat Hepatitis". The New York Times.
- ^ Armstrong, Drew (21 March 2014). "Gilead's $84,000 Treatment Questioned by U.S. Lawmakers". Bloomberg. Diakses tanggal 27 October 2015.
- ^ Lucio, Steven (February 2015). "The Increasing Impact of High-Cost Specialty Therapies". Pharmacy Purchasing & Products Magazine. Diarsipkan dari versi asli tanggal 2015-12-08. Diakses tanggal 4 December 2015.
- ^ Brennan, T.; Shrank W. (2014). "New expensive treatments for hepatitis C infection". JAMA. hlm. 593–594. Missing or empty
|url=(bantuan) - ^ "Gilead Q4 2014 Earnings Call".
- ^ "New Lower Prices for Gilead Hepatitis C Drugs Reach CTAF Threshold for High Health System Value" (Siaran pers). 2015-02-17. Diakses tanggal 2015-02-22. "Salinan arsip". Diarsipkan dari versi asli tanggal 2015-02-22. Diakses tanggal 2017-06-08.
- ^ California Technology Assessment Forum (2014-03-10). "Treatments for Hepatitis C". Diarsipkan dari versi asli tanggal 2014-10-20. Diakses tanggal 2017-06-08.
- ^ "Medical Groups Question Price of New Hep C Drug". The New York Times. Associated Press. 11 March 2014.[pranala nonaktif permanen]
- ^ "Gilead strikes Sovaldi price deal in Germany as it picks up speed in EU". Diarsipkan dari versi asli tanggal 2015-02-19. Diakses tanggal 2017-06-08.
- ^ "Sovaldi / Sofosbuvir medication in Switzerland". Diarsipkan dari versi asli tanggal 2016-10-04. Diakses tanggal 2017-06-08.
- ^ "NHS England rollout of ground-breaking drugs 'changes role of NICE'". Health Service Journal. 4 April 2016. Diakses tanggal 14 May 2016.
- ^ "C형간염 치료제 건강보험 적용". Diakses tanggal 2 August 2016.
- ^ 무단전재, Ⓒ 종합 경제정보 미디어 이데일리-상업적; 금지, 재배포 (20 April 2016). "C형 간염 치료제 신약, 내달 1일부터 건강보험 적용". Diarsipkan dari versi asli tanggal 2016-05-31. Diakses tanggal 2 August 2016.
- ^ "Pricing, Manufacturing & Distribution | Access to Medicine Index 2014". Diarsipkan dari versi asli tanggal 2015-02-06. Diakses tanggal 2017-06-08.
- ^ amfAR Feb. 2015 Hepatitis C and Drug Pricing: The Need for a Better Balance Diarsipkan 2016-04-07 di Wayback Machine.
- ^ Drugs for Neglected Diseases Initiative April 2016 An Alternative Research and Development Strategy to Deliver Affordable Treatments for Hepatitis C Patients
- ^ Gilead.
- ^ Doctors without Borders.
- ^ Einhorn, Bruce. "How India's Patent Office Destroyed Gilead's Global Game Plan". Bloomberg.com. Diakses tanggal 2015-12-30.
- ^ Michael Mezher for Regulatory Affairs Professionals Society.
- ^ Jyothi Datta for the Hindu Business Line.
- ^ "DOCTORS OF THE WORLD—MÉDECINS DU MONDE OPPOSES SOFOSBUVIR PATENT IN EUROPE". Médecins du Monde. Diarsipkan dari versi asli tanggal 2015-02-12. Diakses tanggal 12 February 2015.
- ^ "European Patent EP2203462, granted 21 May 2014". European Patent Register. European Patent Office. Diakses tanggal 12 February 2015.
- ^ Nicola Kuhrt (February 10, 2015). "Hepatitis-Pille Sovaldi: "Ärzte der Welt" geht gegen Patent vor" (dalam bahasa German). Der Spiegel. Diakses tanggal February 10, 2015.
- ^ "Conflit autour d'un traitement contre l'hépatite C" (dalam bahasa French). February 10, 2015. Diakses tanggal March 4, 2015.
- ^ "Charity challenges Gilead's European patent on hepatitis C therapy Sovaldi". February 10, 2015. Diakses tanggal March 4, 2015.
- ^ "High Cost of Sovaldi Hepatitis C Drug Prompts a Call to Void Its Patents - The New York Times".
- ^ Childs-Kean, Lindsey (January 16, 2015). "Simeprevir and Sofosbuvir for Treatment of Chronic Hepatitis C Infection". Clinical Therapeutics. 37 (2): 243–67. doi:10.1016/j.clinthera.2014.12.012. PMID 25601269.
- ^ Smith, Michael (December 16, 2014). "Interferon-/Ribavirin-Free Regimen for Chronic Hepatitis C Virus Infection". Annals of Pharmacotherapy. 49 (3): 343–50. doi:10.1177/1060028014563952. PMID 25515863. Diarsipkan dari versi asli tanggal 2015-02-27. Diakses tanggal 2017-06-08.
- ^ "Comparison of tenofovir prodrugs: TAF vs TDF". DRUG R&D INSIGHT. Diakses tanggal 24 November 2015.
- ^ Murakami, E.; Tolstykh, T.; Bao, H.; Niu, C.; Steuer, H. M. M.; Bao, D.; Chang, W.; Espiritu, C.; Bansal, S. (26 August 2010). "Mechanism of Activation of PSI-7851 and Its Diastereoisomer PSI-7977". Journal of Biological Chemistry. 285 (45): 34337–34347. doi:10.1074/jbc.M110.161802. PMC 2966047 . PMID 20801890.