Insulin aspart
Insulin aspart adalah jenis insulin medis yang dimodifikasi yang digunakan untuk mengobati diabetes tipe 1 dan tipe 2. Insulin ini umumnya digunakan dengan cara disuntikkan di bawah kulit, tetapi dapat juga digunakan dengan cara disuntikkan ke pembuluh darah. Efek maksimal terjadi setelah sekitar 1–3 jam dan bertahan selama 3–5 jam. Umumnya, insulin yang bekerja lebih lama seperti insulin NPH juga diperlukan.[1]
| |
|---|---|
| Data klinis | |
| Nama dagang | NovoLog, NovoRapid, Fiasp, others |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a605013 |
| Data lisensi | US Daily Med:pranala |
| Kat. kehamilan | A(AU) |
| Status hukum | Harus dengan resep dokter (S4) (AU) ℞-only (CA) POM (UK) ℞-only (US) ℞ Preskripsi saja |
| Rute | Subcutaneous, intravenous |
| Pengenal | |
| Nomor CAS | 116094-23-6 |
| Kode ATC | A10AB05 |
| PubChem | CID 16132418 |
| DrugBank | DB01306 |
| ChemSpider | none |
| UNII | D933668QVX |
| KEGG | D04475 |
| ChEMBL | CHEMBL1201496 |
| Data kimia | |
| Rumus | C256H381N65O79S6 |
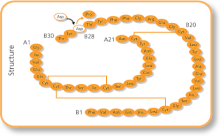
Efek samping yang umum termasuk gula darah rendah, reaksi alergi, gatal, dan nyeri di tempat suntikan. Efek samping serius lainnya mungkin termasuk kalium darah rendah.[1] Penggunaan pada kehamilan dan menyusui umumnya aman.[2] Insulin ini bekerja sama dengan insulin manusia dengan meningkatkan jumlah glukosa yang diserap jaringan dan mengurangi jumlah glukosa yang dibuat oleh hati.[1] Insulin ini adalah bentuk insulin manusia yang diproduksi; di mana satu asam amino telah diubah, khususnya prolin dengan asam aspartat pada posisi B28.[3]
Insulin aspart disetujui untuk penggunaan medis di Amerika Serikat pada tahun 2000.[1] Pembuatannya melibatkan ragi, yang telah memiliki gen insulin aspart yang dimasukkan ke dalam genom mereka.[4] Ragi ini kemudian membuat insulin, yang dipanen dari bioreaktor.[5]
Kegunaan dalam medis
Efek samping
Formulasi
Kemiripan biologis
Pada bulan Desember 2020, Committee for Medicinal Products for Human Use (CHMP) dari Badan Obat-obatan Eropa mengadopsi opini positif, merekomendasikan pemberian otorisasi pemasaran untuk produk obat Kixelle, yang ditujukan untuk pengobatan diabetes.[34] Pemohon untuk produk obat ini adalah Mylan IRE Healthcare Limited. Kixelle disetujui untuk penggunaan medis di Uni Eropa pada bulan Februari 2021.[35] Kixelle berganti nama menjadi Kirsty.[1]
Trurapi disetujui untuk penggunaan medis di Kanada pada bulan Oktober 2020.[36]
Truvelog dan Truvelog Solostar disetujui untuk penggunaan medis di Australia pada bulan Oktober 2020.[3][7]
Pada bulan Oktober 2021, Kirsty disetujui untuk penggunaan medis di Kanada.[37]
Pada bulan Februari 2022, CHMP mengadopsi opini positif, merekomendasikan pemberian otorisasi pemasaran untuk produk obat Truvelog Mix 30, yang ditujukan untuk pengobatan diabetes.[38] Pemohon untuk produk obat ini adalah sanofi-aventis groupe.[38] Produk ini disetujui untuk penggunaan medis di Uni Eropa pada bulan April 2022.[16][39]
Dalam budaya masyarakat
Referensi
- ^ a b c d "Insulin Aspart Monograph for Professionals". Drugs.com (dalam bahasa Inggris). American Society of Health-System Pharmacists. Diarsipkan dari versi asli tanggal 6 March 2019. Diakses tanggal 3 March 2019.
- ^ "Insulin aspart Pregnancy and Breastfeeding Warnings". Drugs.com. Diarsipkan dari versi asli tanggal 6 March 2019. Diakses tanggal 3 March 2019.
- ^ Turner JR (2010). New Drug Development: An Introduction to Clinical Trials: Second Edition. Springer Science & Business Media. hlm. 32. ISBN 9781441964182. Diarsipkan dari versi asli tanggal 20 April 2021. Diakses tanggal 11 September 2020.
- ^ Banga AK (2005). Therapeutic Peptides and Proteins: Formulation, Processing, and Delivery Systems, Second Edition. CRC Press. hlm. 13. ISBN 9781420039832. Diarsipkan dari versi asli tanggal 20 April 2021. Diakses tanggal 11 September 2020.
- ^ Schmid RD, Schmidt-Dannert C (2016). Biotechnology: An Illustrated Primer. John Wiley & Sons. hlm. 222. ISBN 9783527677566. Diarsipkan dari versi asli tanggal 20 April 2021. Diakses tanggal 11 September 2020.